Im Profilbereich Molecular & Translational Medicine arbeiten Grundlagenforschung und Klinik eng zusammen. Die Forschungsgebiete umfassen Kardiologie, Onkologie, Neurowissenschaften sowie Arzneimittelforschung. Im Zentrum stehen die Erforschung molekularer pathophysiologischer Prozesse sowie personalisierte Behandlungsstrategien. Mit der klinischen Translation sollen Erkenntnisse der Grundlagenforschung schneller in die Behandlung der Patienten integriert werden. Ein wesentliches Ziel ist die Entwicklung innovativer Therapeutika. Die translationale Forschung wird zudem unterstützt durch die zunehmend wichtige Rolle von »Data Science« in der Medizin.

Das Exzellenzcluster Cardio-Pulmonary Institute erforscht seit 2006 molekulare Prozesse im Zusammenspiel von Herz und Lunge. Neuerdings arbeiten die Grundlagenforscher*innen intensiv mit Kolleg*innen aus dem klinischen Bereich zusammen – zum Beispiel, wenn es um eine verengte Herzklappe geht.
Das perfekte Zusammenspiel von Herz und Lunge basiert auf komplexen und genau aufeinander abgestimmten molekularbiologischen Prozessen. Solange diese im Gleichgewicht sind, ist der Körper jederzeit mit genügend Blut und Sauerstoff versorgt. Was aber passiert in einzelnen Zellen und Geweben, wenn Herz und Lunge erkranken? Das ist seit 2019 eine der Leitfragen der Forscher*innen am Cardio-Pulmonary Institute (CPI) – einem Exzellenzcluster in der aktuellen Förderperiode der Exzellenzstrategie der Länder und des Bundes. Denn nach wie vor sind Herz- und Lungenerkrankungen die weltweit häufigste Todesursache. Die Corona-Pandemie hat unlängst erst gezeigt, dass bei der Behandlung der beiden lebenswichtigen Organe noch viele Fragen offen sind.
Das Cardio-Pulmonary Institute konzentriert sich verstärkt auf den Transfer von der Grundlagenforschung in die klinische Anwendung.
»Herz und Lunge kann man nicht getrennt voneinander erforschen. Deshalb war es uns als Herzspezialist*innen wichtig, eng mit den Lungen-Forscher*innen an der Universität Gießen und dem Max-Planck-Institut für Herz- und Lungenforschung in Bad Nauheim zusammenzuarbeiten«, erklärt Sprecherin Prof. Stefanie Dimmeler. Die Kooperation begann 2006 mit dem Exzellenzcluster Cardio-Pulmonary System (gefördert bis 2019). Während dieser Zeit hat sich ein einzigartiger Forschungsverbund entwickelt, der auf die Interaktion beider Organe spezialisiert ist. Das Cardio-Pulmonary Institute (CPI) fokussiert nun verstärkt auf den Transfer von der Grundlagenforschung zur klinischen Anwendung. Zusätzlich zu den fünf Forschungsfeldern, die sich mit speziellen molekularbiologischen Prozessen beschäftigen, gibt es drei »Translationsmodule«, in denen intensiv mit Ärztinnen und Ärzten zusammengearbeitet wird. Etwa die »Präzisionsmedizin«, die Erkenntnisse aller Forschungsfelder nutzt, um daraus neue individualisierte Therapieansätze zu entwickeln.
Wenn mutierte Zellen dem Herzen schaden
Ein aktuelles Beispiel für diese Art interdisziplinärer Zusammenarbeit ist die Behandlung der Aortenklappenstenose – eine Verengung der Aortenklappe in der linken Herzhälfte durch »Verkalkung«. Sie tritt ab etwa 65 Jahren gehäuft auf. Die Risikofaktoren sind – im Gegensatz zur Atherosklerose – nicht bekannt. Ohne einen chirurgischen oder Katheter-basierten Klappenersatz haben nur die Hälfte der Betroffenen eine Chance, die nächsten zwei Jahre zu überleben. Dabei kann man nicht vorhersagen, welche Patient*innen höchstwahrscheinlich sterben werden. Und welche auch ohne Operation überleben würden. Bei älteren und geschwächten Patient*innen lässt sich das Operationsrisiko inzwischen senken, indem sie eine neue Herzklappe ohne Öffnung des Brustkorbs mittels Katheter erhalten. Das Universitätsklinikum Frankfurt ist auf dieses sogenannte TAVR-Verfahren spezialisiert.
Um die Risiken für Patient*innen mit Aortenklappenstenose einschätzen zu können, werden Kenntnisse auf der Zellebene gebraucht: Bisher ist bekannt, dass die »Verkalkung« der Aortenklappe mit einer gestörten Funktion der Endothelschicht an deren Oberfläche beginnt. Dies ruft Immunzellen auf den Plan, und es kommt zu Entzündungsreaktionen. Schließlich wird das Herzklappengewebe umgebaut, wobei die Verkalkungen entstehen.
Ein weiterer Risikofaktor liegt für Kardiolog*innen in dem Umstand, dass sich die linke Herzhälfte durch das Pumpen gegen den Widerstand der verengten Klappe vergrößert. Dabei kommt es zu einer krankhaften Vermehrung von Bindegewebszellen im Herzmuskel (Fibrose). Kardiolog*innen vermuten, dass dies der Grund ist, weshalb nach einem erfolgreichen Klappenersatz dennoch jede/r fünfte Patient*in innerhalb von drei Jahren verstirbt. Die Ursachen dafür erforscht Prof. Andreas Zeiher im Rahmen eines ERC Advanced Grants (CHIP-AVS), den der Europäische Forschungsrat 2022 bewilligt hat.
Die langjährige Zusammenarbeit von Kliniker*innen und Wissenschaftler*innen der Schwerpunktprogramme von Kardiologie und Hämatologie/Onkologie spielt bei der Ursachenforschung eine zentrale Rolle. Aus Forschungsarbeiten des Hämatologen Prof. Michael Rieger ist bereits bekannt, dass Blutstammzellen dabei eine wichtige Rolle spielen. Diese werden im Knochenmark gebildet und können sich zu roten und weißen Blutzellen sowie Blutplättchen differenzieren. Mit zunehmendem Alter mutieren Blutstammzellen. Einige erhalten dadurch einen Überlebensvorteil, sodass sie sich stärker vermehren. Da alle Blutzellen des Körpers sich ständig aus Stammzellen im Knochenmark regenerieren, werden diese Mutationen auch an reife Blutzellen weitergegeben. Es entstehen Klone mutierter Blutzellen (klonale Hämatopoese). Einige dieser Klone stellen Risikofaktoren für Atherosklerose, Herzschwäche, koronare Herzkrankheit, Herzinfarkt und Aortenklappenstenosen dar.
Die Gruppe um Michael Rieger hat erstmals im Blut von Patient*innen mit Aortenklappenstenose Klone mit einer bestimmten Genmutation gefunden. Das Gen kodiert ein Enzym mit der Abkürzung DNMT3A. »Mutationen in DNMT3A sind die häufigsten Treiber der klonalen Hämatopoese«, berichtet er. Mithilfe des hochmodernen »Single Cell Sequencing« konnte die Gruppe von Prof. Wesley Abplanalp am CPI auf der Ebene einzelner Zellen feststellen: Mutationen dieses Gens führen dazu, dass auch Gene für entzündungsfördernde Signalstoffe vermehrt abgelesen werden.
Entzündungen werden also durch klonale Hämatopoese verstärkt. »Dies ist vermutlich der Grund, warum wir im Körper alternder Menschen oft unterschwellige Entzündungen beobachten. Sie begünstigen Erkrankungen und erhöhen die Sterblichkeit«, sagt Michael Rieger. Dies passt zu der Beobachtung, dass Immunzellen und ihre Botenstoffe (Zytokine) sowohl bei der Klappenverkalkung als auch bei der krankhaften Linksherzvergrößerung beteiligt sind.
»DNMT3A könnte die Entzündungsreaktion mit anschließender Verkalkung der Aortenklappe sowie den fibrotischen Umbau des Herzmuskels verursachen«, vermutet Dr. Silvia Mas-Peiro, Leiterin des Aortenklappenprojekts. Für ihren Kollegen Dr. Sebastian Cremer, der die Untersuchungen zur Herzschwäche leitet, ist interessant, dass das mutierte Gen auch bei seinen Patient*innen auffällig oft als Klon aufritt. Vieles spricht dafür, dass es der gesuchte Marker ist, mit dem sich das Fortschreiten einer Aortenklappenstenose vorhersagen lässt. »Wenn wir den Krankheitsmechanismus entschlüsselt haben, können wir die Therapiemöglichkeiten aufgrund verbesserter Risikoabschätzung optimieren«, fasst Andreas Zeiher zusammen.
(ahv)
Exzellenzcluster Cardio-Pulmonary Institute (CPI)
Co-Projektleitung: Goethe-Universität
Beteiligte Institutionen-Partner: Fachbereiche Biowissenschaften und Medizin der Goethe-Universität, Justus-Liebig-Universität Gießen, Max-Planck-Institut für Herz-und Lungenforschung Bad Nauheim
Förderzeitraum: 1.1.2019 bis 31.12.2025

Nachgefragt bei...
Stefanie Dimmeler
Welches Problem wollen Sie gern besser verstehen?
Wir wollen Herz- und Lungenerkrankungen besser verstehen, diagnostizieren und behandeln. Wie man am Beispiel COVID sehen kann, stehen wir auch immer wieder vor neuen Herausforderungen.
Warum ist das Thema wichtig?
Herz- und Lungenerkrankungen sind leider nach wie vor die Haupttodesursachen.
Was ist ein Etappenziel?
Neue therapeutische Ziele zu identifizieren und möglicherweise erstmals am Menschen anzuwenden.
Was darf nicht passieren?
Sich auf vergangenen Erfolgen ausruhen.
Wie gehen Sie mit Misserfolgen um?
Nachdem ich mich geärgert habe, versuche ich aus den Misserfolgen zu lernen und besser zu werden. Mein Motto ist: »Erfolge lassen wachsen, Misserfolge lassen reifen.«
Wie feiern Sie Erfolge?
Am liebsten am und auf dem Wasser mit dem Team, das zum Erfolg beigetragen hat.
Prof. Dr. Stefanie Dimmeler ist Direktorin des Instituts für Kardiovaskuläre Regeneration im Zentrum für Molekulare Medizin und Sprecherin des Exzellenzclusters »Cardio-Pulmonary Institute«.
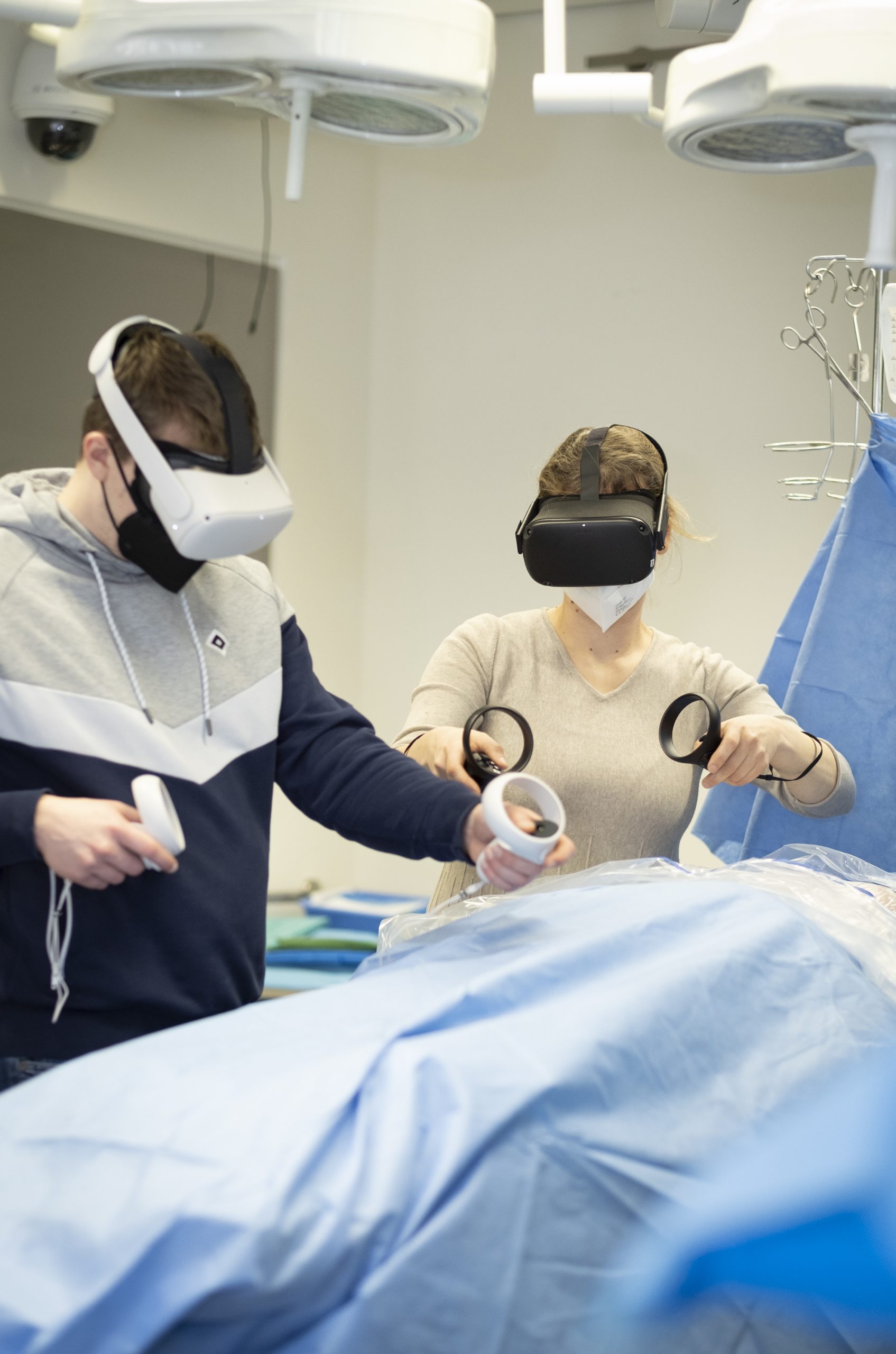
Die meisten medizinischen Fehler entstehen, weil Kommunikation versagt. Miriam Rüsseler geht mit diesem Manko kreativ um: In dem von ihr entwickelten Room of Error lernen Menschen aus Gesundheitsberufen, im Team zu arbeiten.
Auf dem Nachttisch ein Haselnussjoghurt, der Rollator in einer Ecke des Zimmers. Die Notrufklingel neben dem Bett am Boden. In der Mitte des Raums: ein bewegungsunfähiger Patient. Dieses Szenario bietet sich angehenden Medizinstudierenden und Krankenpfleger*innen, sobald sie die Virtual-Reality(VR)-Brille des Room of Error aufgesetzt haben. Finde die Fehler: Nur wer sein Auge für Feinheiten und scheinbar Unbedeutendes schult, wird im Krankenzimmer des virtuellen Simulationsprogramms Dinge entdecken, die das Leben des Patienten gefährden können (steht in der Krankenakte etwa etwas über Nussallergie?).
70 Prozent aller medizinischen Fehler gehen laut Studien auf menschliches Versagen zurück, erklärt Prof. Miriam Rüsseler, Ärztin und ausgebildete Medizindidaktikerin am Frankfurter Uniklinikum. »Konkret heißt das, es gibt Fehler in der Kommunikation, in der Teamführung und in der Entscheidungsfindung.« Aufmerksamkeit zu schulen, vor allem unter Stress, ist deshalb das Ziel des von Rüsseler entwickelten Room of Error für angehende Ärzt*innen und Pfleger*innen. Und: interprofessionelle Teamkompetenzen zu fördern, eine Fehlerkultur zu entwickeln und unsichtbare Schranken zwischen Pflege- und Arztberuf zu überwinden, die sich durch seit Generationen praktiziertes Hierarchiedenken verfestigt haben.
(K)eine Lücke im Lehrplan
Die Leiterin des Frankfurter Interdisziplinären Simulationstrainings hat in der Pandemie schnell reagiert: Nachdem der reale Room of Error nicht mehr betretbar und praktische Lehre am Bett nicht mehr möglich waren, ließ sie kurzfristig ein virtuelles Simulationsprogramm samt VR-Brille entwickeln (gefördert unter anderem durch den Goethe-Corona-Fonds, mehr dazu unter Campus). Der Vorteil: Von jedem beliebigen Ort können sich Studierende in den Raum einer Notaufnahme, einer Normal-, Intensiv- oder Operationsstation versetzen, dort am Fall lernen – und anschließend mit anderen Kursteilnehmern ihre Beobachtungen austauschen. »Im Gespräch liegt der eigentliche Lerneffekt«, erklärt Rüsseler. »Angehende Ärztinnen und Ärzte wissen viel zu wenig über die Kompetenz in anderen Gesundheitsberufen. Sicherheit für den Patienten gibt es aber nur in einem Team, in dem jeder die Fähigkeiten der anderen kennt und schätzt.«
Schon als Medizinstudentin hat Miriam Rüsseler diese Lücke im Lehrplan gestört. Deshalb entwickelte sie Projekte zur Verbesserung der medizinischen Lehre und steckte Preisgelder in ihre eigene didaktische Weiterbildung, wie etwa den »Master of Medical Education«. 2019 startete sie dann das Lehrprojekt »Durch Barrieren schneiden« mit dem interprofessionellen Schockraumtraining im Lernzentrum des Frankfurter Uniklinikums. Miriam Rüsseler hat mehr vor: Den Room of Error sollen nicht nur die etwa 100 Studierenden der Chirurgie im letzten Ausbildungsjahr, dem Praktischen Jahr, erleben. »Langfristig sollten alle Lernenden am Uniklinikum die Möglichkeit bekommen.« Gerade rekrutiert Rüsseler dazu weitere Trainerinnen und Trainer.
Was sie antreibt: »Herzblut«, kommt ihre Antwort spontan. Es mache ihr unglaublichen Spaß, interprofessionelle medizinische Teams zu fördern. Dass sie mit ihrem Projekt im hierarchisch geprägten Klinikalltag mitunter gegen Betonwände rennt, bremst sie dabei nur kurzzeitig. Ihr Erfolg spricht dafür, dass sie auf dem richtigen Weg ist: Im Sommer 2022 soll Miriam Rüsseler auf die neu gegründete Professur für Medizindidaktik und klinische Simulation an Universität und Uniklinikum Frankfurt berufen werden. Damit verbunden ist der Aufbau eines Akademischen Gesundheitszentrums. Simulationsprogramme als Training für den Ernstfall werden dabei eine prominente Rolle spielen – als Mittel zum Zweck für die eigentlichen Protagonisten: Fehlerkultur und Teamkompetenz. Damit die medizinische Versorgung noch besser wird.

Das Forschungsprojekt TRiC erforscht, warum Krebszellen gegen Therapien resistent sind. Und welche Medikamente dies ändern können. Deshalb arbeiten Grundlagenforscher*innen und Kliniker*innen eng zusammen.
Therapieresistenzen sind die häufigste Todesursache bei Krebserkrankungen. Manche Krebszellen besitzen bereits vor der Behandlung eine Resistenz, andere entwickeln sie im Zuge der Behandlung. Die Ursachen dafür sind vielfältig: Sie können in der Tumorzelle selbst oder im umliegenden Gewebe liegen. Sie können durch äußere Faktoren wie Infektionen beeinflusst sein oder durch den Lebensstil der Patient*innen.
Das Forschungsprojekt TRiC (Targeting Resistance in Cancer) will die komplexen Ursachen für Resistenzen in einem Netzwerk aus Expert*innen der Medizin, Chemie, Pharmazie und Informatik aufschlüsseln. TRiC beruht auf drei Säulen: 1. Therapieresistenz bei Krebs verstehen und Angriffspunkte für neue Medikamente finden; 2. Medikamente entwickeln und testen; 3. Komplexe Zusammenhänge mit Künstlicher Intelligenz verstehen.
Ein Beispiel dafür, wie wichtig das Verständnis der Resistenzen ist, veranschaulicht die Therapie für Enddarmtumore. Sie ist in vielen Fällen erfolgreich: In den vergangenen Jahren wurde eine Kombination aus Radio- und Chemotherapie entwickelt, die auf eine Operation verzichten kann. »Allerdings gibt es immer auch Patientinnen und Patienten, die nicht oder nur unzureichend auf die Standard-Radiochemotherapie ansprechen«, erklärt Prof. Claus Rödel, Leiter der Klinik für Radioonkologie. Gemeinsam mit Prof. Emmanouil Fokas leitet er die Deutsche Rektumkarzinom-Studiengruppe, die diese neue Therapieform untersucht.
Wenn Krebszellen auf KI treffen
Um den Resistenzmechanismus besser zu verstehen, wandten sich die Kliniker an Prof. Florian Greten. Er ist Sprecher des LOEWE-Zentrums Frankfurt Cancer Institute (FCI), an dem interdisziplinäre Teams die molekularen Mechanismen der Krebsentstehung untersuchen und daraus individuelle Therapien ableiten. Bei der Untersuchung von Gewebe- und Blutproben machten die Grundlagenforscher*innen eine überraschende Entdeckung: Nicht die Tumorzellen sind der entscheidende Faktor für die Resistenz, sondern die umgebenden entzündlich veränderten Bindegewebszellen (also das Tumormikromillieu).
Den Wissenschaftler*innen gelang es, einen bestimmten entzündungsfördernden Botenstoff medikamentös zu hemmen. Daraufhin wurde der Krebs durch Bestrahlung wieder angreifbar, wie die Forschenden am FCI im Tierversuch zeigen konnten. Nun wird das entzündungshemmende Medikament in einer klinischen Studie an Krebspatienten getestet.
Die Forschenden haben außerdem herausgefunden, dass Patient*innen, deren Blutserum Rezeptoren für einen entzündlichen Botenstoff enthält, bessere Chancen haben, auf die Radiochemotherapie anzusprechen. »Somit können wir auch voraussagen, bei wem voraussichtlich eine antientzündliche Begleittherapie hilfreich sein könnte«, erläutert Dr. Adele Nicolas, Wissenschaftlerin aus dem Georg-Speyer-Haus und Erstautorin der Studie. Im Forschungsprojekt TRiC soll dieser Ansatz nun auf verschiedene Krebsarten ausgedehnt werden.
In Frankfurt besteht in der Krebsforschung seit der Gründung des UCT im Jahr 2009 eine langjährige Expertise. Einer der Meilensteine für die translationale Forschung, also den engen Austausch zwischen Grundlagenforschung und Klinik, war die Gründung des Frankfurt Cancer Institute 2019. Dass eine gezielte Suche nach Wirkstoffen in Datenbanken möglich ist und diese Wirkstoffe Wissenschaftlern*innen öffentlich zugänglich gemacht werden, ist der Gründung des Structural Genomics Consortium (SGC) zu verdanken. Die Goethe-Universität ist seit 2017 einer der Hauptstandorte des SGC, der derzeit die Zusammenarbeit von etwa 200 Wissenschaftler*innen an renommierten akademischen Instituten sowie acht pharmazeutischen Firmen koordiniert. Der SGC initiierte das von Prof. Stefan Knapp an der Goethe-Universität geleitete EU-Netzwerk EUbOPEN: Es hat zum Ziel, eine Substanzbibliothek zu entwickeln aus kleinen, hoch selektiven chemischen Modulatoren, die die Proteinfunktion verändern. So sollen gezielt grundlegende biologische und krankheitsrelevante Prozesse aufgeklärt werden.
„Schon jetzt können Systeme Künstlicher Intelligenz zuverlässig Hautkrebs erkennen.“
Kristian Kersting
Neu hinzu im Forschungsprojekt kommt die Künstliche Intelligenz (KI). »Schon jetzt können KI-Systeme, die mit Expertenwissen trainiert werden, zuverlässig Hautkrebs erkennen«, erläutert Kristian Kersting, Professor für Künstliche Intelligenz und Maschinelles Lernen an der Technischen Universität Darmstadt, mit der die Goethe-Universität in der Allianz der Rhein-Main-Universitäten (RMU) kooperiert. Was Informatiker*innen in TRiC nun anstreben, ist weitaus komplexer. Sie wollen klinische Daten wie Laborwerte, MRT- oder Ultraschallbilder mit Informationen über die Gene und Proteine einzelner Patient*innen in Verbindung bringen. Die Analyse von Gendefekten bei Krebs hat in den vergangenen Jahren dazu geführt, dass (Chemo-)Therapien immer mehr individualisiert werden können. Inzwischen sind Protein-Defekte verstärkt in den Fokus gerückt. Sie können beispielsweise als spezifische molekulare Marker für Krankheiten genutzt werden und stellen einen weiteren Schritt zur individualisierten Therapie dar.
Um in den riesigen Datenmengen, die man inzwischen für einzelne Patient*innen gewinnen kann, neue Zusammenhänge und Faktoren für Resistenzen erkennen zu können, braucht es Künstliche Intelligenz. Das ist für KI-Forscher wie Kersting eine Herausforderung, denn er muss dem System »beibringen«, nach etwas zu suchen, das menschliche Expert*innen ihm nicht vorgeben können. Und wenn das System einen Zusammenhang gefunden hat, muss es prüfende Fragen eines Menschen »beantworten« können. »Wenn wir die KI auf biomedizinische Systeme anwenden, müssen wir ganz neue Methoden entwickeln, die das gesamte Feld der KI einen großen Schritt voranbringen werden«, erwartet Kersting.
(ahv)
TRiC
Projektleitung: Goethe-Universität (Sprecher), Technische Universität Darmstadt
Beteiligte Institutionen – Partner: Georg-Speyer-Haus (GSH), Max-Planck-Institut für Herz- und Lungenforschung Bad Nauheim, Max-Planck-Institut für terrestrische Mikrobiologie Marburg, Paul-Ehrlich-Institut, Blutspendezentrum Frankfurt, LOEWE-Zentrum Frankfurt Cancer Institute (FCI), Universitäres Centrum für Tumorerkrankungen (UCT), Deutsches Konsortium für Translationale Krebsforschung (DKTK), Structural Genomics Consortium (SGC), Hessian Center for Artificial Intelligence (hessian.AI), IMI (Innovative Medicines Initiative) Projekt EUbOPEN, LOEWE-Schwerpunkt TRABITA
PM zu Cancer Cell Paper Nicolas et al.: https://georg-speyer-haus.de/cancercell_nicolas/
Link zum Image-Film: https://fci.health/forschung/querschnittsprogramme/

Nachgefragt bei...
Hubert Serve
Welches Problem wollen Sie mit dem Clusterprojekt TRiC gern besser verstehen?
Wir wollen verstehen, warum manche Patientinnen und Patienten auf Krebstherapien besser und andere schlechter ansprechen.
Was ist Ihnen daran persönlich wichtig?
Wir erleben zurzeit, dass viele neue Medikamente und Methoden auf den Markt drängen. Daraus ergibt sich eine Vielzahl von Kombinationsmöglichkeiten. Wir möchten die beste individuelle Kombination für die jeweiligen Patientinnen und Patienten herausfinden –, aber dafür reichen die klassischen Untersuchungsmethoden nicht mehr aus.
Was ist ein Etappenziel?
Wir möchten für möglichst klar definierte Gruppen von Patient*innen in einer relevanten Situation belastbare Lösungen aufzeigen, um Therapieresistenz zu überwinden.
Was ist die größte Hürde?
Die größte Hürde ist es, die Komplexität der Signalwege, die zur Therapieresistenz führen, zu verstehen. Wir werden für diese schwierige Frage neue, computerunterstütze Methoden verwenden, wie zum Beispiel Künstliche Intelligenz (KI).
Wie gehen Sie mit Misserfolgen um?
Wir handeln nach der Devise: »Try harder«. Leider ist man es in der Medizin gewohnt, dass man viele verschiedene Ansätze verfolgen muss, bis dann am Ende einer funktioniert. Aber grundsätzlich sind Misserfolge ein Ansporn.
Wie feiern Sie Erfolge?
Wenn ich in die Augen von Patientinnen und Patienten sehe, die leben, weil wir gemeinsam mit ihnen die ausgetretenen Pfade verlassen konnten und neue Therapieansätze erfolgreich waren, dann ist das für mich der schönste Erfolg.
Prof. Dr. Hubert Serve leitet die Medizinische Klinik II am Frankfurter Uniklinikum und ist Principal Investigator (PI) am Forschungsprojekt TRiC.
Unser Forschungsprofil: Raum für gute Antworten
Mit sechs Profilbereichen will die Goethe-Universität ihre Kompetenzen stärker bündeln.

