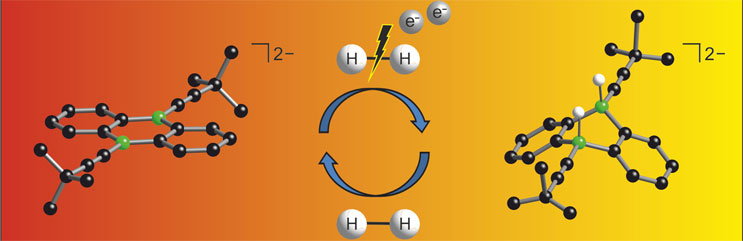
Wasserstoff (H2) ist ein denkbar einfaches Molekül und dennoch ein wertvoller Rohstoff, der durch die Entwicklung ausgefeilter Katalysatoren immer mehr an Bedeutung gewinnt. In der Industrie und Wirtschaft reichen die Anwendungsgebiete von der Lebens- und Düngemittelherstellung über das Cracken von Erdöl bis zum Einsatz als Energieträger in Brennstoffzellen. Eine Herausforderung besteht darin, die starke H─H-Bindung unter milden Bedingungen zu spalten. Chemiker der Goethe-Universität haben nun einen neuen Katalysator zur Aktivierung von Wasserstoff entwickelt, indem sie in ein gängiges organisches Molekül gezielt Bor-Atome einschleusten. Das in der Fachzeitschrift „Angewandte Chemie“ beschriebene Verfahren benötigt zusätzlich nur noch eine Elektronenquelle und sollte daher zukünftig breit einsetzbar sein.
Dem hohen Energieinhalt des Wasserstoffmoleküls steht eine besonders stabile Bindungssituation gegenüber. Erstmals erkannte Paul Sabatier im Jahre 1897, dass Metalle geeignete Katalysatoren sind, um das Molekül zu spalten und elementaren Wasserstoff für chemische Reaktionen nutzbar zu machen. Für diese wichtige Entdeckung erhielt er 1912 den Nobelpreis für Chemie. Die heutzutage meistverwendeten Hydrierkatalysatoren enthalten giftige oder teure Schwermetalle wie Nickel, Palladium oder Platin. Erst vor zehn Jahren wurden metallfreie Systeme aus Bor- und Phosphorverbindungen entdeckt, die vergleichbare Reaktionen ermöglichen.
„Meiner Doktorandin, Esther von Grotthuss, ist nochmals eine deutliche Vereinfachung der metallfreien Strategie gelungen, die allein die Borkomponente benötigt“, so Prof. Matthias Wagner vom Institut für Anorganische und Analytische Chemie der Goethe-Universität. „Zusätzlich brauchen wir lediglich noch eine Elektronenquelle. Im Labor haben wir hierfür Lithium oder Kalium gewählt. Für eine Übertragung in die Praxis sollte sich stattdessen elektrischer Strom nutzen lassen“.
Um Einzelheiten der Wasserstoffaktivierung über experimentelle Befunde hinaus aufzuklären, wurden in Kooperation mit Prof. Max Holthausen (Goethe Universität) quantenchemische Rechnungen durchgeführt. Detaillierte Kenntnisse des Reaktionsverlaufs tragen wesentlich dazu bei, das System weiter auszubauen. Das Ziel besteht nicht allein darin, Übergangsmetalle langfristig zu ersetzen, sondern darüber hinaus Reaktionen zu erschließen, die mit den konventionellen Katalysatoren nicht möglich sind.
Die Frankfurter Chemiker halten insbesondere Substitutionsreaktionen für vielversprechend, die einen günstigen Zugang zu Verbindungen des Wasserstoffs mit anderen Elementen gestatten. Für solche Synthesen werden meist noch kostspielige und gefahrenträchtige Verfahren eingesetzt. Beispielsweise wäre eine vereinfachte Herstellung von Silizium-Wasserstoff-Verbindungen höchst attraktiv für die Halbleiterindustrie.
[dt_call_to_action content_size=“small“ background=“plain“ line=“true“ style=“1″ animation=“fadeIn“]
Publikation: E. von Grotthuss et al: Reversible Dihydrogen Activation by Reduced Aryl Boranes as Main-Group Ambiphiles, in: Angew. Chem. Int. Ed. 2016, DOI: 10.1002/anie.201608324
[/dt_call_to_action]