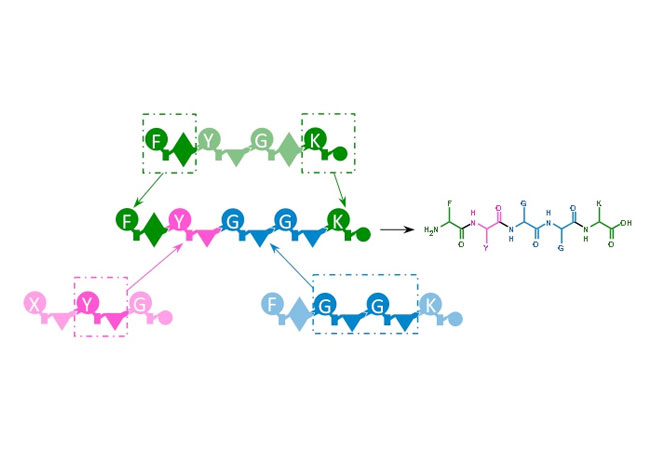
Mikroorganismen bauen Naturstoffe oft wie am Fließband zusammen. Dabei spielen bestimmte Enzyme, die nicht-ribosomalen Peptid Synthetasen (NRPS), eine Schlüsselrolle. Biotechnologen der Goethe-Universität ist es jetzt gelungen, diese Enzyme nach eigenen Wünschen zu designen, so dass sie ganz neue Naturstoffe erzeugen können.
Viele wichtige Naturstoffe wie Antibiotika, Immunsuppressiva oder Mittel gegen Krebs stammen aus dem Stoffwechsel von Mikroorganismen. Dabei handelt es sich meistens um kleine Eiweißmoleküle (Peptide), die in der Zelle mit Hilfe der NRPS-Enzyme wie am Fließband in einer modernen Autofabrik entstehen: an jeder Station werden dem Grundgerüst weitere Teile zugefügt, bis am Ende das fertige Auto aus der Fabrik rollt. Im Fall der NRPS findet an jeder Station (genannt Modul) der Einbau und die Prozessierung einer bestimmten Aminosäure statt, so dass am Ende ketten-, ringförmige oder anders modifizierte Peptide entstehen, die auch ungewöhnliche Aminosäuren tragen können.
Obwohl die grundlegenden Prinzipien der NRPS schon lange bekannt sind, war es bisher kaum möglich, diese Enzyme zu modifizieren. In den wenigen Fällen, wo es gelang, einzelne Module auszutauschen, nahm die Produktion des veränderten Naturstoffs deutlich ab. Vollkommen unmöglich schien der Zusammenbau ganz neuer Enzyme, die dementsprechend auch ganz neue Naturstoffe erzeugen können. Dies ist der Arbeitsgruppe von Prof. Helge Bode, Merck Stiftungsprofessur für Molekulare Biotechnologie an der Goethe Universität, nun gelungen.
„Wir nutzen natürliche NRPS-Systeme aus Bakterien im Prinzip nur noch als Bausteine, die wir über von uns identifizierte Schnittstellen neu zusammenfügen“, erläutert Bode den Forschungsansatz. Die Ausbeuten sind dabei vergleichbar mit der natürlichen Produktion dieser Naturstoffe.
Die Methode ist inzwischen so gut ausgearbeitet, dass sie von Anfängern bereits nach kurzer Einarbeitung zur Herstellung neuer Wirkstoffe genutzt werden kann. Allerdings war es bis dahin ein weiter Weg. „Ich hatte Glück, dass mich bei diesem Projekt Mitarbeiter unterstützten, die sich nicht leicht entmutigen ließen, sehr fleißig waren und auch außerhalb etablierter Pfade der Wissenschaft denken konnten“, erklärt Bode. „Die von uns genutzte Schnittstelle zum Zusammenfügen der einzelnen Bausteine liegt so, dass die natürlichen Stationen der Biosynthese nicht mehr eingehalten werden müssen“.
Nun geht es darum, die ersten klinischen Wirkstoffe mit dieser Methode zu modifizieren und biotechnologisch herzustellen. Zudem soll die Methode noch weiter verbessert werden, um auch verwandte Naturstoffklasse modifizieren zu können oder sogar wie in der Natur ganze Bibliotheken von Naturstoffen zu erzeugen. Die ersten Ergebnisse sind vielversprechend.
[dt_call_to_action content_size=“small“ background=“fancy“ line=“true“ style=“1″ animation=“fadeIn“]
Publikation: Kenan A. J. Bozhüyük, Florian Fleischhacker, Annabell Linck, Frank Wesche, Andreas Tietze, Claus-Peter Niesert, Helge B. Bode: De novo design and engineering of non-ribosomal peptide synthetases, Nature Chemistry, https://www.nature.com/nchem/, DOI: 10.1038/nchem.2890
[/dt_call_to_action]