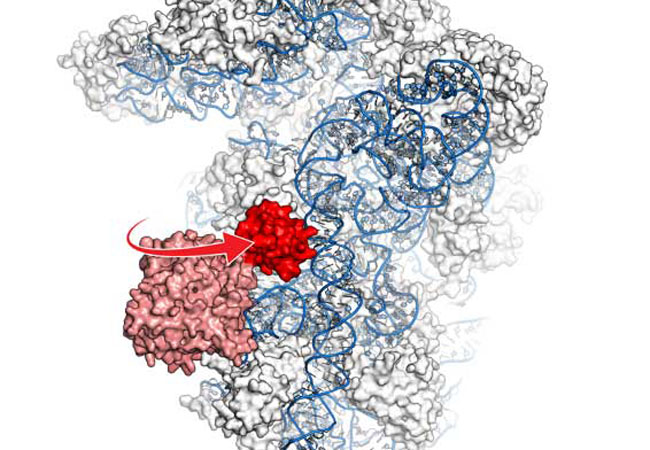
Eines der wichtigsten Moleküle des Lebens, das Ribosom, übersetzt die genetische Information in Proteine (Translation). Die molekulare Maschine besteht aus zwei Untereinheiten, die gespalten und wiederverwendet werden, um eine neue Runde der Proteinsynthese einzuleiten. Dabei spielt das als „eiserner Hammer“ bekannte Protein ABCE1 eine wichtige Rolle. Forscher der Goethe-Universität haben den Prozess jetzt zusammen mit Kollegen des Genzentrums der LMU München im Detail aufgeklärt. Dabei stellten sie fest, wie ABCE1 die Spaltung des Ribosoms katalysiert und die nächste Translationsrunde einleitet.
Die Gruppen von Prof. Robert Tampé vom Institut für Biochemie der Goethe-Universität und von Prof. Roland Beckmann am Genzentrum in München klärten die Struktur von ABCE1 an der kleinen ribosomalen Untereinheit mithilfe der Kryo-Elektronenmikroskopie auf. Der strukturell hochaufgelöste Komplex ist sozusagen der Punkt am Satzende der Übersetzung und wird als Post-Spaltungskomplex bezeichnet. Zu ihrer Überraschung erkannten die Forscher, dass ein bestimmter Bereich von ABCE1 (die Eisen-Schwefel-Cluster Domäne) wie ein Hammerkopf geformt ist, der sich bei seiner Arbeit um 180-Grad dreht.
Hierbei werden die beiden ribosomalen Einheiten auseinandergetrieben und deren Re-Assoziation verhindert. Dieser Prozess wird durch ATP, den Energieträger der Zelle, angetrieben. Die in der aktuellen Ausgabe der Fachzeitschrift „Nature Structural and Molecular Biology“ publizierte Struktur zeigt den molekularen Motor ABCE1 in einer asymmetrischen Konformation. Dies erlaubt Rückschlüsse auf den fundamentalen Mechanismus der Protein-Biosynthese. Beim Menschen sind viele medizinisch relevante Prozesse, die Moleküle durch die Zellmembran transportieren, mit diesen asymmetrisch aufgebauten Motoren gekoppelt.
Weiterhin fanden die Forscher heraus, wie ABCE1 eine neue Runde der Translation einleitet. Lange war bekannt, dass ABCE1 mit so genannten Initiationsfaktoren wechselwirkt, welche die Protein-Biosynthese in Gang setzen. Jetzt konnten sie erstmals die Co-Assoziation mit spezifischen Komponenten des Initiationskomplexes aufzeigen. Daraus ergibt sich für die weitere Forschung die Frage, wie ABCE1 mit der Rekrutierung von Initiationsfaktoren gekoppelt ist. Das erscheint durchaus wahrscheinlich, denn die Forscher haben mithilfe genetischer Ansätze herausgefunden: Wenn sie die Wechselwirkung von ABCE1 mit dem Ribosom nur geringfügig verändern, kann dies zu drastischen physiologischen Effekten führen.
„Gemeinsam konnten wir ein fehlendes Bindeglied in der Protein-Biosynthese, von einem Zyklus zum nächsten aufklären. Die Arbeit schließt den essentiellen Kreislauf des Lebens für die Homöostase, Differenzierung und Entwicklung von Zellen und Organismen“, fasst Robert Tampé die Bedeutung der Arbeit zusammen.
[dt_call_to_action content_size=“small“ background=“fancy“ line=“true“ style=“1″]
Publikation:
André Heuer, Milan Gerovac, Christian Schmidt, Simon Trowitzsch, Anne Preis, Peter Kötter, Otto Berninghausen, Thomas Becker, Roland Beckmann & Robert Tampé (2017): Structure of the 40S-ABCE1 post-splitting complex in ribosome recycling and translation initiation. Nature Structure and Molecular Biology, doi:10.1038/nsmb.3396
[/dt_call_to_action]