SARS-CoV-2-Viren gelingt es, menschliche Zellen mit einem Minimum eigener Proteine zu kapern und als Brutkästen für ihre Nachkommen zu nutzen. Eines der viralen Multifunktionsproteine ist das Nucleocapsidprotein (N), das in Vervielfältigung und Verpackung eine zentrale Rolle spielt. Forschende der Goethe-Universität haben jetzt herausgefunden, wie N sowohl virale RNA allgemein als mithilfe von „Fingern“ auch spezifische RNA-Positionen erkennt. Die spezifische Erkennung ist an die erhöhte Temperatur der Wirtszelle angepasst. Möglicherweise wird Fieber, das wir im Laufe einer Infektion entwickeln, von SARS-CoV-2 zur Umschaltung von Virus-Vervielfältigung auf Virus-Freisetzung genutzt.
Unmittelbar nach einer Infektion einer Zelle in Rachen oder Lunge arbeitet das SARS-CoV-2 Virus mit Hochdruck an seiner Vervielfältigung. Dabei nutzt es die Stoffwechselwege der menschlichen Zelle, um seine Proteine herstellen und sein Erbgut (das RNA-Genom) kopieren zu lassen. Schließlich wird das RNA-Genom sehr kompakt in neue Viruspartikel verpackt, die aus der Zelle freigesetzt werden, um weitere Zellen zu infizieren.
Für die schnelle und effiziente Vermehrung ist besonders ein Virusprotein wichtig, das so genannte Nucleocapsid-Protein (N). Im Virus umhüllt es das RNA-Genom und sorgt dafür, dass die sehr lange RNA kompakt aufgewickelt ist. Beim Eindringen in die Zelle löst sich N vom RNA-Genom und übernimmt jetzt im Laufe der viralen Vermehrung eine ganze Reihe von Funktionen: Wenn die RNA in Virusproteine übersetzt wird, schützt N die RNA davor, dass der Virus-Abwehrmechanismus der Zelle („RNA-Interferenz“) sie zerstört. N wirkt auch direkt bei der Umschreibung in Virusproteine mit, und schließlich sammelt es die vervielfältigte virale RNA in der Zelle ein und wickelte sie auf, damit neue Viruspartikel gebildet werden können.
Wie ein Schweizer Taschenmesser verfügt N für all diese Funktionen über mehrere Werkzeuge: Zum einen muss N zwischen zellulärer und virale RNA unterscheiden und letztere spiralförmig aufwickeln können. Daher ist N in der Lage, verhältnismäßig unspezifisch virale RNA zu binden. Um beispielsweise die Umschreibung der viralen RNA in Virusproteine (Translation) zu steuern, muss N jedoch ebenso in der Lage sein, bestimmte Positionen auf der Virus-RNA zu erkennen, so genannte RNA-Motive.
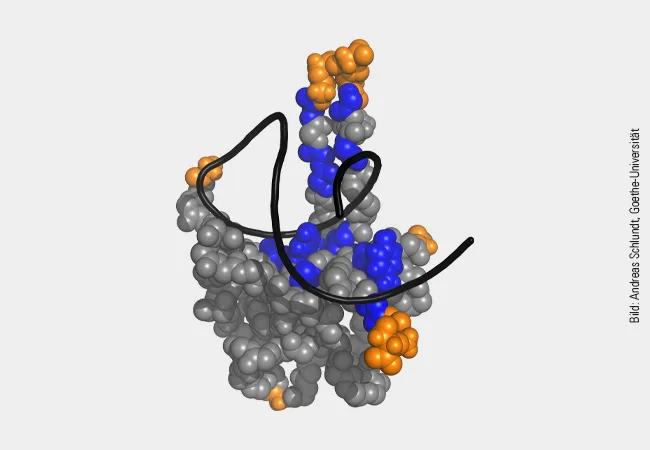
Wie diese spezifische Bindung durch eines der Werkzeuge von N, der sogenannten N-terminalen Domäne (NTD), genau funktioniert, haben jetzt Wissenschaftler:innen um Dr. Sophie Korn und Dr. Andreas Schlundt vom Institut für Molekulare Biowissenschaften und dem Zentrum für biomolekulare magnetische Resonanzspektroskopie (BMRZ) der Goethe-Universität aufgeklärt. Ihre Ergebnisse bauen auf Vorarbeiten des während der Pandemie in Frankfurt gegründeten Covid19-NMR-Konsortiums auf. In der vorliegenden Arbeit nutzten Korn und ihre Kollegen die Kernspinresonanz- oder NMR-Spektroskopie, bei der die Atome des NTD-Werkzeugs und der gebundenen RNA einem starken Magnetfeld ausgesetzt werden und so etwas über ihre räumliche Anordnung bei der Bindung verraten. Außerdem gab ein spezielles Röntgenstrahlverfahren (Kleinwinkel-Röntgenstreuung, SAXS) präzise Informationen über die Stabilität der neu gebildeten Molekülkomplexe.
Das Ergebnis: Sowohl die Abfolge der RNA-Bausteine (Basen) ist für eine Bindung wichtig als auch die räumliche Faltung der RNA. Dabei bindet der positiv geladene Teil der NTD recht unspezifisch die negativ geladene RNA. Mehrere „Finger“ der NTD tasten danach die RNA nach Motiven ab, mit denen die NTD stabilere Bindungen eingehen kann. Was den Forscher:innen auffiel: Die Motive, die die NTD bevorzugt, liegen bei der Körpertemperatur in Lungenzellen in einer bestimmten räumlichen Faltung vor, die bereits bei wenigen Grad Temperaturerhöhung verloren geht. Dadurch werden diese nicht nur als eigene Ziel-Motive identifiziert, sondern auch deutlich stärker gebunden, was zur Ausübung neuer Funktionen der NTD führen könnte.
Sophie Korn meint: „Unsere Daten sind zwar nur ein erster Schritt, aber sie lassen die Vermutung zu, dass das Virus auf diese Weise zwischen Vervielfältigung und Verpackung in neue Viruspartikel umschalten könnte: Bei normaler Körpertemperatur werden in der Zelle vorwiegend Bausteine für neue Viren hergestellt. Bekommen wir im Verlauf der Infektion Fieber, weil das Virus von unserem Immunsystem erkannt und bekämpft wird, so schaltet das Virus möglicherweise als direkte Folge auf die Vervielfältigung um und sorgt dafür, dass die virale RNA vermehrt verpackt und in Form neuer Viruspartikel freigesetzt wird. Den Schalter liefern die Virus-RNA-Motive selbst, betätigt wird der Schalter vom Abwehrsystem des Menschen.“
Publikation: Sophie Marianne Korn, Karthikeyan Dhamotharan, Cy M. Jeffries, Andreas Schlundt: The preference signature of the SARS-CoV-2 Nucleocapsid NTD for its 5’-genomic RNA elements. Nature Communications (2023) https://doi.org/10.1038/s41467-023-38882-y
Hintergrundinformationen
Das COVID19-NMR-Konsortium
https://covid19-nmr.de/