Ein wichtiger Mechanismus, mit der die Zelle Energie gewinnt, ist die so genannte Atmungskette in den zelleigenen Kraftwerken (Mitochondrien). In einer neuen Studie haben Forscherinnen und Forscher der Goethe-Universität Frankfurt, des Max-Planck-Instituts für Biophysik und der Universität Helsinki eine hochaufgelöste Struktur eines zentralen Biomoleküls der Atmungskette, dem mitochondrialen Komplex I, bestimmt und seine Funktionsweise im Computer simuliert. Die Erkenntnisse helfen sowohl der Grundlagenforschung wie auch beim Verständnis bestimmter neuromuskulärer und neurodegenerativer Erkrankungen, die von Mitochondrien ausgehen.
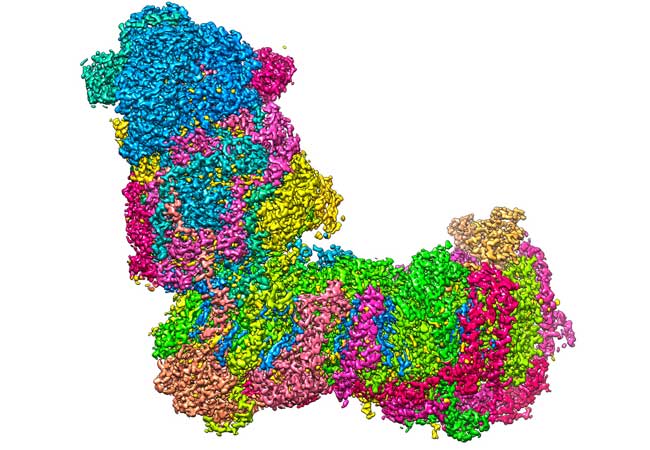
Alle Lebensprozesse erfordern eine ständige Versorgung mit Energie. In der Zelle wird diese Energie hauptsächlich über das chemisch „aufgeladene“ Molekül ATP zur Verfügung gestellt. Erzeugt werden die ATP-Energiepakete unter anderem in spezialisierten kleinen Organen („Organellen“) der Zelle, den Mitochondrien.
Dort läuft die Energiegewinnung ähnlich ab wie in einem Pumpspeicherkraftwerk: Über die Atmungskette werden Wasserstoffionen (Protonen mit positiver Ladung) von einer Seite der inneren Mitochondrien-Membran auf die andere gepumpt (sozusagen bergauf), sodass ein chemisches Konzentrationsgefälle und eine elektrische Spannung entstehen. Entlang dieses elektrochemischen Gradienten „fließen“ die Protonen „bergab“ durch eine Art Turbine, die für die Zelle nutzbare Energie in Form von ATP erzeugt.
Eine der Protonenpumpen im ersten Schritt des Prozesses ist ein großes, L-förmiges Biomolekül, der mitochondriale Komplex I (kurz: Komplex I). Mit seinem waagerechten Arm ist das L in der Membran verankert. Am senkrechten Arm des L bindet er das Elektronenträgermolekül NADH, das aus der Verstoffwechselung beispielsweise von Zucker stammt. Komplex I katalysiert die Übertragung von Elektronen von NADH auf Ubichinon (Q10) und die in dieser Reaktion freiwerdende Energie wird zum Antrieb der Protonenpumpe genutzt.
Dem Forscherteam der Goethe-Universität Frankfurt und des Max-Planck-Instituts für Biophysik in Frankfurt ist es gelungen, die 3D-Struktur von Komplex I über hochauflösende Bildgebungsverfahren (Kryoelektronenmikroskopie) exakt zu vermessen und abzuleiten, auf welchen Wegen die Protonen innerhalb des Komplex I transportiert werden. Hierbei spielen, so konnten die Wissenschaftlerinnen und Wissenschaftler zeigen, Wassermoleküle in der Proteinstruktur eine wichtige Rolle.
Die hochaufgelösten Strukturdaten ermöglichten umfangreiche Computersimulationen durch Kolleginnen und Kollegen der Universität Helsinki, die zeigten, wie sich die Pumpe während des Protonentransports wahrscheinlich bewegt.
Dr. Janet Vonck vom Max-Planck-Instituts für Biophysik erklärt: „Unsere Studie gibt neue Einblicke in die Funktionsweise einer molekularen Maschine der biologischen Energieumwandlung.“ Prof. Volker Zickermann vom Institut für Biochemie II der Goethe-Universität Frankfurt meint: „Dieses Wissen kann dazu beitragen bestimmte mitochondriale Krankheiten wie zum Beispiel die Augenkrankheit Lebersche hereditäre Optikusneuropathie besser zu verstehen.“
Publikation: Kristian Parey, Jonathan Lasham, Deryck J. Mills, Amina Djurabekova, Outi Haapanen, Etienne Galemou Yoga, Hao Xie, Werner Kühlbrandt, Vivek Sharma, Janet Vonck, Volker Zickermann: High-resolution structure and dynamics of mitochondrial complex I—Insights into the proton pumping mechanism. Sci Adv. 2021 Nov 12;7(46) https://www.science.org/doi/10.1126/sciadv.abj3221