Bioinformatiker der Goethe-Universität haben das erste mathematische Modell für einen zentralen Verteidigungsmechanismus der Zelle gegen das Bakterium Salmonella entwickelt. Sie können ihren experimentell arbeitenden Kollegen damit wertvolle Anregungen zur Aufklärung der beteiligten Signalwege geben.
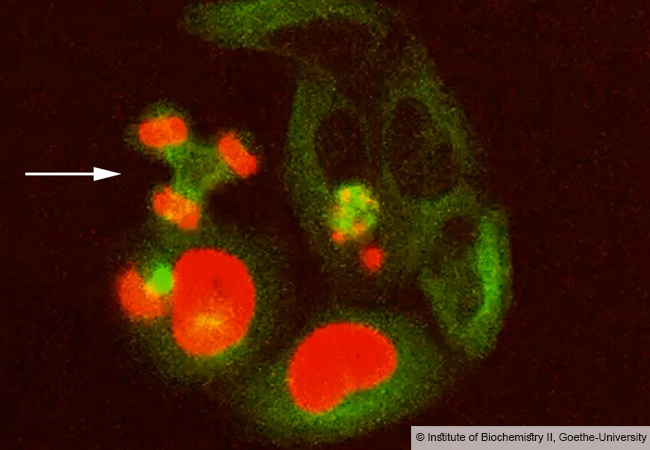
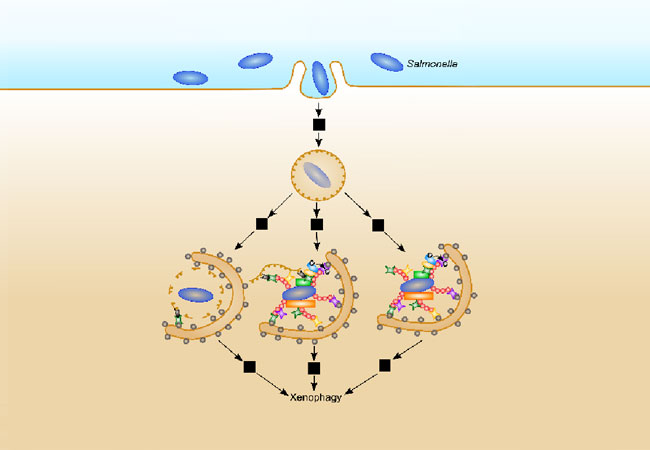
Jedes Jahr sind Salmonellen weltweit für Millionen von Infektionen und tausende Todesfälle verantwortlich. Die Körperzellen können sich aber gegen die Eindringlinge verteidigen, indem sie die Bakterien in speziellen Zellorganellen, den Autophagosomen, einschließen und durch die Verschmelzung mit andern Zellorganellen, den Lysosomen, verdauen. Um neue Therapien gegen Salmonellen zu finden, ist es wichtig, diesen als Xenophagie bekannten Prozess besser zu verstehen.
Wie die Bioinformatik-Gruppe von Prof. Ina Koch in der aktuellen Ausgabe von „PLOS Computational Biology“ berichtet, hat sie in Zusammenarbeit mit dem Molekularbiologen Prof. Ivan Dikic vom Institut für Biochemie II ein mathematisches Modell der Xenophagie erstellt. In der Studie kombinieren die Forscherinnen und Forscher bereits bekanntes Wissen über die molekularen Interaktionen mit einer Methode aus der Informatik, den Petri-Netzen. Diese finden in der theoretischen Biologie zunehmend Anwendung.
Um das Modell zu überprüfen, simulierten die Bioinformatiker, was passieren würde, wenn Proteine des Xenophagie-Signalweges ausgeschaltet werden – diese Technik nennt man „in silico-Knockout“. Die in silico-Vorhersagen stimmten mit den Ergebnissen von Studien überein, in denen Proteine experimentell ausgeschaltet wurden. Diese Übereinstimmung bestätigt, dass das Modell die bekannten Teile des Xenophagie-Prozesses gut reproduziert.
Zusätzlich schlugen die Bioinformatiker einen neuen Mechanismus für ein Protein vor, das am Xenophagie-Prozess beteiligt ist. Diese und andere durch in silico-Knockout vorgeschlagenen Hypothesen geben den Forschern im Labor wertvolle Hinweise für zukünftige Experimente.
“Die in silico-Knockout-Experimente stellen Hypothesen für zukünftige experimentelle Studien auf, die zu einem besseren Verständnis der zellulären, antibakteriellen Verteidigung beitragen können”, erläutert Erst-Autorin Jennifer Scheidel.
[dt_call_to_action content_size=“small“ background=“fancy“ line=“true“ style=“1″ animation=“fadeIn“]
Publikation: Scheidel J, Amstein L, Ackermann J, Dikic I, Koch I (2016) In Silico Knockout Studies of Xenophagic Capturing of Salmonella. PLoS Comput Biol 12(12): e1005200. doi:10.1371/ journal.pcbi.1005200
[/dt_call_to_action]