Rolf Marschalek löste das Rätsel mit zwei deutschen Kollegen.
Wer bei Rolf Marschalek ins Büro kommt, kann als Geimpfter die Maske ablegen. „Wir arbeiten hier praktisch unter 2G-Bedingungen“, sagt der Professor am Institut für Pharmazeutische Biologie. Er ist ein überzeugter Befürworter der Impfung gegen COVID-19. Deshalb ließ es ihm keine Ruhe, als die ersten Fälle von Thrombosen nach einer Impfung mit dem Vektor-Impfstoff Astra-Zeneca bekannt wurden. Gemeinsam mit zwei weiteren deutschen Arbeitsgruppen in Ulm und Greifswald gehörte er zu den drei Forschern weltweit, die sich damit intensiv beschäftigten. „Und wir haben zusammen das Rätsel geknackt“, sagt Marschalek nicht ohne Stolz.
Den 26. Mai 2021 wird Marschalek nicht so schnell vergessen. An diesem Tag veröffentlichte er seine vorläufigen Ergebnisse auf dem Preprint-Server „Researchsquare“. Innerhalb eines Tages gehörte die Publikation zu den meistgelesenen auf dem Server. Marschaleks E-Mail-Programm zählte bald 1000 Anfragen. Überwältigt ging er an diesem Tag nach Hause. Inzwischen hat er sich an die Publicity und die Nachfragen von Journalisten aus aller Welt gewöhnt. Zudem ist er sehr aktiv in den fachspezifischen Foren für COVID-19 auf Facebook. Dort teilt er sein Wissen in Form von Artikeln, die er dort auf Deutsch, Englisch und Italienisch publiziert.
Von der Leukämie- zur Corona-Forschung
Doch zurück zu den Anfängen: Bis zum Beginn der Pandemie hatte Marschalek, Professor am Institut für Pharmazeutische Biologie der Goethe-Universität, nie an Corona-Viren geforscht. In Deutschland gab es zu diesem Zeitpunkt nur wenige Virologen, die sich damit auskannten (u. a. Christian Drosten in Berlin). Marschaleks Arbeitsgruppe beschäftigte sich seit vielen Jahren mit den genetischen Veränderungen, die zu Leukämie führen. Dann kam der Lockdown im April 2020. „Ich fragte meine Mitarbeiter, ob sie zu Hause bleiben wollten oder mit Volldampf in die Corona-Forschung einsteigen“, erinnert sich Marschalek. Denn: „Alles, was wir in der Krebsforschung machen, kann man auch auf andere Probleme anwenden.“
So nahm Marschalek mit dem Team der Virologin Sandra Ciesek Kontakt auf, die kurz zuvor nach Frankfurt berufen worden war. Er bot an, jedes einzelne der 28 Gene im SARS-COV-2-Virus und wichtige Gene des Interferon-Weges zu klonieren und ein neues, zelluläres Nachweissystem zu entwickeln. „Für den anstehenden Berg an Aufgaben war das Team von Sandra Ciesek damals einfach unterbesetzt“, erklärt Marschalek, „und so wurde unsere Hilfe dankbar angenommen.“
Durch Arbeiten weltweit war sehr bald klar, dass das Virus bei den gefährlich erkrankten Menschen die Immunantwort aus dem Gleichgewicht bringt. Wissenschaftlich gesprochen: Einzelne Proteine des Virus schalten gezielt den Interferon-Weg aus. Dadurch treten entzündliche Prozesse in den Vordergrund, die zu schwerwiegenden und lang andauernden Organschäden führen. Zudem bringt das Virus zwei Enzyme (Proteasen) mit, die neben den Virusproteinen auch zelluläre Proteine des Menschen zerschneiden. Das Immunsystem erkennt sie dann nicht mehr als körpereigene Proteine an, was ein vielfältiges Spektrum an Autoimmun-Antworten auslöst (inklusive der Long-COVID-Symptome).
Den Thrombose-Ursachen auf der Spur
Währenddessen hatten Labore weltweit daran gearbeitet, Impfstoffe gegen SARS-COV-2 zu entwickeln. Marschalek las die Fachliteratur aufmerksam. Sein Corona-Ordner umfasst mittlerweile 3,5 Gigabyte und die Artikelliste ist geschätzt einen Kilometer lang. Als die ersten Meldungen über gefährliche Thrombosen der Sinus-Venen durch den Impfstoff von Astrazeneca erschienen, war der Forscher besorgt. Zunächst befürchtete er, die durch den Impfstoff gebildeten Antikörper könnten mit dem Blutplättchenfaktor PF4 wechselwirken. „Eine solche Kreuzreaktion wäre durchaus denkbar gewesen, denn wir haben zwischen PF4 und dem Spike-Antigen eine zufällige Übereinstimmung in einem Abschnitt des genetischen Codes gefunden“, erklärt Marschalek.
Hätte sich eine Kreuzreaktion durch die Impfung bestätigt, hätte das eine erhöhtes Thrombose-Risiko bei allen Impfstoffen bedeutet. Marschalek machte sich auf die Suche nach einem Spezialisten für Blutgerinnungsstörungen und kam auf Vermittlung des Paul-Ehrlich-Instituts in Kontakt mit Prof. Andreas Greinacher an der Universitätsklinik in Greifswald. Glücklicherweise konnten die beiden Forscher den Verdacht ausräumen. Das Ergebnis ist im Juli 2021 in der Zeitschrift „Blood“ publiziert worden.
Parallel dazu verfolgte Marschalek noch eine weitere Spur mit der Gruppe von Stefan Kochanek, einem Spezialisten für Gentherapie am Universitätsklinikum Ulm. Er hatte gerade das gesamte Spektrum der Proteine in den Impfstoffen der verschiedenen Hersteller untersucht und bei Astrazeneca Verunreinigungen durch Hitzschock-Proteine nachgewiesen. Diese Proteine entstehen als Nebenprodukte bei der Herstellung des Impfstoffs in menschlichen Zelllinien. Sie können bestehende Entzündungsprozesse verstärken und Autoimmunreaktionen herbeiführen. „Solche Verunreinigungen sind eine der Ursachen für die sofortigen Impfnebenwirkungen, die viele direkt nach der Impfung erfahren“, erklärt Marschalek. „Ob sie auch für die thrombotischen Ereignisse von Bedeutung sind, die vier bis sechzehn Tage danach auftreten, ist nach wie vor unklar.“
Fehlerquelle bei Vektor-Impfstoffen entdeckt
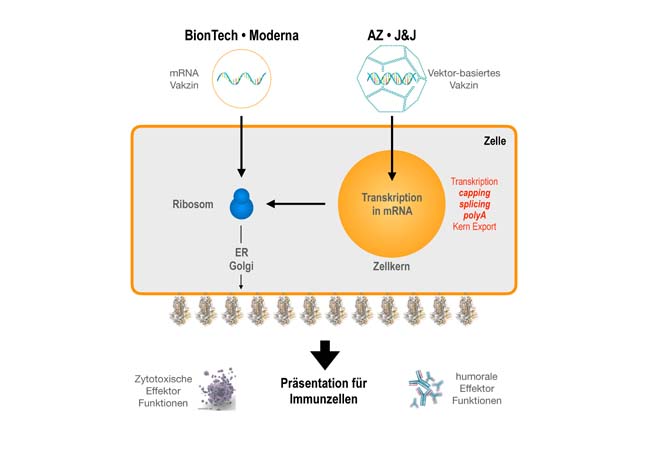
Rechts: Vektoren-basierte Impfstoffe (AZ, J&J) transportieren den Bauplan für das Spike-Protein in Form von DNA in den Zellkern, wo das Spike Gen transkribiert wird. Die gebildete RNA durchläuft die drei klassischen Kernprozesse (Capping, Spleißen und poly-Adenylierung), um dann als reife mRNA ins Zytoplasma zu gelangen. Ab dem Ribosom verläuft der Weg wie bei den mRNA-Impfstoffen.
Marschalek und seine Mitarbeiter hatten aber noch ein prinzipielles Problem entdeckt, das auftritt, wenn man die Gene des SARS-COV-2 Virus in den Zellkern einschleust. Nämlich, dass sie dort falsch interpretiert werden. Das gilt auch für das Gen mit dem Bauplan für das Spike-Protein. Im Zellkern wird das virale Gen ebenso abgelesen wie unsere zellulären Gene: die unreife Vorläufer-RNA wird nach bestimmten Spleiß-Sequenzen abgesucht, die dazu dienen, die nicht-kodierenden Bestandteile der Vorläufer-RNA zu entfernen, um daraus eine reife mRNA herzustellen (messenger oder Boten-RNA).
Nun ist es aber so, dass die RNA für das Spike-Protein von SARS-COV-2 gar keine nicht-kodierenden Bestandteile enthält. Trotzdem besitzt sie zufällige Spleißsignale, die im natürlichen Lebenszyklus des Virus aber nicht stören, da dieses Virus sich ausschließlich im Zytosol (also außerhalb des Zellkerns) seiner Wirtszellen vermehrt. Wird die mRNA aber, wie im Fall der Impfstoffe von Astrazeneca oder Johnson & Johnson im Zellkern hergestellt, passieren unbeabsichtigte Fehler: Die virale Spike-RNA wird nach dem Abschreiben in RNA an vielen Stellen durch Spleißprozesse verändert.
Die Folge dieser Spleiß-Fehler sorgt für ein Wirrwar in der Zelle. So wird das Spike-Protein entweder verkürzt oder es fusioniert mit Teilen anderer Proteine der Wirtszelle. In den meisten Fällen fehlt dem viralen Spike-Protein der wichtige „Membran-Anker“, der es auf der Zelloberfläche festhält. Dort sollte es normalerweise den Zellen des Immunsystems präsentiert werden, sodass es zur Antikörperbildung und der Aktivierung von T-Zellen kommen kann. Ohne den „Membran-Anker“ wandert das Virus-Protein vom Muskelgewebe der Impfstelle am Oberarm in die Blutbahn und kann als lösliches Spike-Varianten-Protein möglicherweise auch Thrombosen auslösen.
Janssen kannte Spleiß-Fehler schon vom Ebola-Impfstoff
Warum sind die Impfstoff-Entwickler dann den „Umweg“ über den Zellkern gegangen? „Weil sie mit Impfstoffen auf DNA-Basis schon mehrere Jahre Erfahrung hatten und dieser Weg die schnellsten Ergebnisse versprach“, sagt Marschalek. Der Leiter der Impfstoff-Entwicklung bei Janssen stellte ihm den Bauplan des Impfstoffs zur Verfügung. Bei diesem Impfstoff traten Spleiß-Fehler nicht so häufig auf wie bei Astzrazeneca. „Die Firma Janssen war bereits bei der Herstellung von Impfstoffen gegen das Ebola-Virus auf Spleiß-Fehler gestoßen“, erklärt Marschalek. „Wenn man das Problem kennt, lässt es sich leicht beheben.“
Astrazeneca-Chef-Entwicklerin »not amused«
Den Impfstoff von Astrazeneca musste Marschalek mit seinem Team selbst sequenzieren. Er konnte nach und nach die Stellen identifizieren, die die Spleiß-Fehler verursachen. „Es war wie in einem Krimi“, erinnert sich der Forscher. Im Juli, zwei Monate nach dem aufsehenerregenden Preprint, präsentierte er seine Ergebnisse im Jenner Institute in Oxford, das den Impfstoff entwickelt und Patent an die schwedische Firma Astrazeneca lizensiert hatte. Der Frankfurter Forscher erklärte in seinem Vortrag, wie es zu den Thrombosen kommen könnte: In der Blutbahn schwimmende Virus-Proteine binden an die Endothelzellen, die die Blutgefäße auskleiden, über das Protein ACE2. Das passiert etwa fünf bis sechs Tage nach der Impfung. Bei Vektor-Impfstoffen bildet der Körper sieben bis 14 Tage nach der Impfung die ersten Antikörper. Sie werfen sich auf das an der Zellwand gebundene Virus-Protein wie Footballspieler auf den gegnerischen Spieler mit dem Ball. So kommt es zu Verklumpungen. Bei Menschen mit einer gesunden Immunantwort greifen allerdings neutralisierende Antikörper ein, um die Entstehung einer Thrombose zu verhindern.
Das erklärt, warum Thrombosen nur sehr selten nach Impfungen auftreten, nämlich mit einer Wahrscheinlichkeit von 1:100.000. Das heißt, man hätte diese Komplikation bei den Studien zur Zulassung des Impfstoffs nur bemerken können, wenn man eine viel höhere Zahl von Probanden getestet hätte als gesetzlich vorgeschrieben. Die Chef-Entwicklerin bei Astrazeneca, Sara Gilbert, war dennoch „not amused“, als Marschalek seine Entdeckungen in Oxford vortrug.
Als Nächstes will der Frankfurter Molekularbiologe seine Thrombose-Hypothese zusammen mit einem Kollegen aus Philadelphia experimentell überprüfen. Der Amerikaner arbeitet mit Mäusen, die das humane ACE2-Protein exprimieren. Diese sollten Thrombosen entwickeln, wenn man ihnen die fehlerhaften Spike-Proteine zusammen mit Serum von Menschen injiziert, die Antikörper gegen SARS-COV-2 gebildet haben. Das Preprint, das im Mai 2021 für so viel Aufsehen gesorgt hat, ist mittlerweile ausgearbeitet und soll demnächst bei einer Fachzeitschrift zur Begutachtung eingereicht werden.
Anne Hardy
Dieser Beitrag ist in der Ausgabe 5/2021 (PDF) des UniReport erschienen.














