Signalmoleküle der Wnt-Familie spielen eine Schlüsselrolle bei der frühen Entwicklung von Mensch und Tier. Gleichzeitig ist ein „Zuviel“ an Wnt ein häufiger Auslöser für Darmkrebs. In Labor-gezüchteten Mini-Därmen konnten Frankfurter Wissenschaftler die Wege des wichtigen Botenstoffes erstmals sichtbar machen. In der aktuellen Ausgabe des Fachmagazins Nature berichten Forscher um Dr. Henner Farin am Georg Speyer Haus, wie sie die neuartige dreidimensionale Darmkultur nutzen, um neue Angriffspunkte zu finden, mit denen sich Wnt in Darmtumoren stoppen lässt.
Henner Farin gehört zusammen mit Forschern der Goethe-Universität zum Deutschen Konsortium für Translationale Krebsforschung (DKTK). Im DKTK verbindet sich das Deutsche Krebsforschungszentrum (DKFZ) in Heidelberg als Kernzentrum langfristig mit onkologisch besonders ausgewiesenen universitären Partnerstandorten in Deutschland. Sprecher ist Prof. Hubert Serve von der Medizinischen Klinik II am Universitätsklinikum der Goethe-Universität.
Der Dünndarm ist ein stark beanspruchtes Organ: Die Verdauungsprozesse und das Darmmilieu sorgen dafür, dass die Zellen der Darmschleimhaut alle drei bis fünf Tage absterben und erneuert werden müssen. Nachschub liefern Millionen kleiner Gruben in der Oberfläche der Darmschleimhaut. Der Boden dieser sogenannten „Krypten“ beherbergt teilungsfähige Stammzellen. Deren Zellnachkommen wandern im Verlauf ihrer Spezialisierung aus der Krypte heraus und reifen zu Darmepithelzellen heran.
Kontrolliert wird die Selbsterneuerung durch den Wnt-Signalweg. Doch die hohe Zellteilungsrate im Darm macht das System fehleranfällig und die Wnt-Regulation gerät leicht außer Kontrolle. Im Durchschnitt entwickelt jeder zehnte Mensch Darmpolypen, die unter Umständen zu bösartigen Tumoren werden können. Bei den über 60-Jährigen hat knapp jeder dritte mindestens einen Polypen im Darm.
DKTK-Wissenschaftler Henner Farin führte die Arbeiten mit Kollegen am University Medical Centers Utrecht durch. Am Partnerstandort Frankfurt hat Henner das neuartige Darmmodell etabliert, um die Erforschung der Wnt-Regulation im Darm fortzuführen.
„In Darmtumoren ist das Wnt-Signal deutlich höher als in gesundem Gewebe. Dadurch werden die Zellen dauerhaft in einen stammzellähnlichen Zustand versetzt. Sie sind prinzipiell unsterblich und können besonders viele Mutationen anhäufen, die Krebs auslösen.“
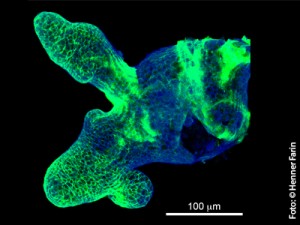
Ein hohes Wnt-Signal ist ein typisches Merkmal von Stammzellen und während der Ausreifung nimmt die Aktivität stetig ab. Lange ging man davon aus, dass der Botenstoff dabei durch Diffusion die Stammzellen erreicht. Zu dieser Theorie passte jedoch nicht die Beobachtung, dass das Signal auf Stammzellen und deren Nachkommen begrenzt bleibt. Die Bilder aus den Mini-Därmen liefern jetzt endlich eine Erklärung: „Der Wnt-Faktor wird auf die Zellmembran der Stammzellen geladen und bleibt dort gebunden. Bei der Zellteilung wird das Signal an die Membranen der Tochterzellen weitergeben und verdünnt sich zwangsläufig“, erklärt Henner Farin. „Die dabei stetig abnehmende Wnt-Menge ist für die Zelle der Auslöser für die Spezialisierung zur Darmzelle.“
Diese Form der zellgebundenen Wnt-Ausbreitung hatte man bisher nur in Fliegen beobachtet. Für die Darmkrebsforschung ist das eine wichtige Erkenntnis, erläutert Henner Farin: „Fast 90 Prozent aller Darmtumoren tragen Mutationen, die eine Erhöhung des Wnt-Signals bewirken. In einem Teil dieser Tumoren reichern Zellen Wnt an, weil der Abbau des membrangebundenen Moleküls nicht mehr funktioniert.“
Dreidimensionale Darmkulturen, sogenannte „Organoide“ sind eine neues Verfahren der Biomedizin. Mit ihrer Hilfe können die Wissenschaftler um Henner Farin die Abbauprozesse von Wnt in Darmtumoren genauer unter die Lupe nehmen. Die Mini-Därme zeigen essentielle Funktionen eines echten Darms und können aktiv Medikamente und Nährstoffe aufnehmen. „An patientenspezifischen Organoiden ist es auch möglich, individuelle Tumoreigenschaften zu vergleichen“, sagt Henner Farin. „Im Deutschen Konsortium für Translationale Krebsforschung könnten damit neue diagnostische Verfahren und Methoden zur Wirkstoffprüfung entwickelt werden.“
In kultivierten Darmkrypten zeigt die Verteilung von Wnt3 die Stammzell-Niche an. Fluoreszenzmikroskopie in 3D Darstellung (Wnt3-Färbung in grün und Zellmembranen in blau)
Publikation:
Farin HF, Jordens I, Mosa MH, Basak O, Korving J, Tauriello DVF, de Punder K, Angers S, Peters PJ, Maurice MM, Clevers H.: Visualization of the short-range Wnt gradient in the intestinal stem cell niche. Nature 2016; DOI:10.1038/nature16937
[dt_call_to_action content_size=“small“ background=“fancy“ line=“true“ animation=“fadeIn“]
Das Deutsche Konsortium für Translationale Krebsforschung (DKTK) ist eine gemeinsame, langfristige Initiative des Bundesministeriums für Bildung und Forschung (BMBF), der beteiligten Bundesländer, der Deutschen Krebshilfe und des Deutschen Krebsforschungszentrums (DKFZ) und wurde als eines der sechs Deutschen Zentren der Gesundheitsforschung (DZGs) gegründet. Mit dem DKFZ kooperieren Forschungseinrichtungen und Kliniken an Standorten Berlin, Dresden, Essen/Düsseldorf, Frankfurt/Mainz, Freiburg, Heidelberg, München und Tübingen, um optimale Bedingungen für die kliniknahe Krebsforschung zu schaffen. Das Konsortium fördert interdisziplinäre Forschungsthemen an der Schnittstelle zwischen Grundlagenforschung und Klinik, sowie klinische Studien zu innovativen Therapie- und Diagnoseverfahren. Ein weiterer Schwerpunkt ist der Aufbau von Forschungsplattformen, um den Einsatz personalisierter Krebstherapien zu beschleunigen und die Diagnose und Prävention von Krebserkrankungen zu verbessern.
[/dt_call_to_action]