Am Hirntumorzentrum des Universitären Centrums für Tumorerkrankungen (UCT) am Universitätsklinikum Frankfurt wurde im Rahmen einer klinischen Phase-I-Studie vor Kurzem erstmalig ein Hirntumorpatient mit genmodifizierten natürlichen Killerzellen (NK-Zellen) behandelt. Das neuartige Zelltherapeutikum für die adoptive Immuntherapie wurde am Standort Frankfurt in einer langjährigen Kooperation zwischen dem Georg-Speyer-Haus und dem Institut für Transfusionsmedizin und Immunhämatologie entwickelt. Die Therapie mit sogenannten CAR-NK-Zellen wird derzeit am UCT im Rahmen der Studie CAR2BRAIN erprobt, finanziell unterstützt durch das LOEWE-Zentrum für Zell- und Gentherapie Frankfurt und das US-amerikanische Biotechnologie-Unternehmen NantKwest.
NK-Zellen sind spezielle Blutzellen des angeborenen Immunsystems und haben die Fähigkeit, bei bestimmten Zielzellen den Zelltod auszulösen. Die in der Studie untersuchten modifizierten Killerzellen tragen einen sogenannten chimären Antigenrezeptor (CAR), der das tumor-assoziierte Antigen HER2 (ErbB2) erkennt und damit die Zerstörung der Tumorzellen befördert. HER2 ist auf der Oberfläche vieler Tumorzellen zu finden und stellt daher ein ideales Angriffsziel für eine zelluläre Immuntherapie dar.
Im Rahmen der CAR2BRAIN-Studie werden Patienten behandelt, die ein HER2-positives Glioblastom – einen bösartigen Hirntumor – haben und sich einer Rezidiv-Operation unterziehen müssen. Die von der NK-Zelllinie NK-92 abgeleiteten CAR-NK-Zellen werden während der Operation in das Operationsgebiet injiziert. Dadurch sollen die trotz Operation zurückbleibenden Tumorzellen attackiert und das patienteneigene Immunsystem auf diese aufmerksam gemacht werden. Der erste Patient wurde am Universitätsklinikum Frankfurt vor einer Woche behandelt und hat die Operation und die Injektion der natürlichen Killerzellen gut überstanden. Weitere Patienten sollen in den nächsten Wochen folgen.
Die klinische Studie wird kooperativ an der Klinik für Neurochirurgie (Prof. Christian Senft) und dem Dr. Senckenbergischen Institut für Neuroonkologie (Dr. Michael Burger, Prof. Joachim Steinbach) unter Mitwirkung weiterer Partnereinrichtungen des Hirntumorzentrums durchgeführt. Studienleiter nach Arzneimittelgesetz ist Dr. Michael Burger.
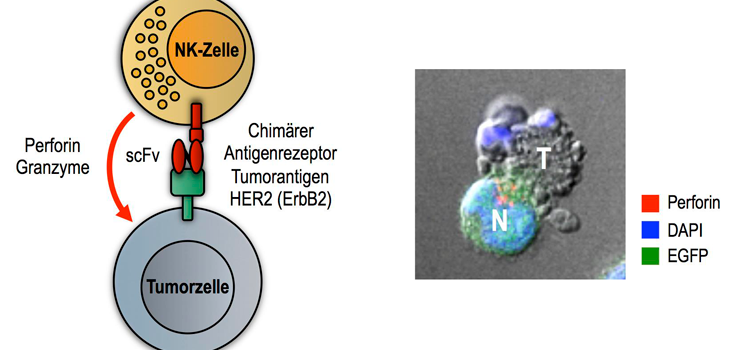
Durch Bindung des chimären Antigenrezeptors über eine Antikörperdomäne (scFv) an das Antigen HER2 auf der Oberfläche von Tumorzellen werden genmodifizierte CAR-NK-Zellen spezifisch aktiviert und setzen zytotoxische Moleküle wie Perforin und Granzyme frei, die den regulierten Zelltod (Apoptose) der Tumorzelle auslösen (schematische Darstellung links). Die mikroskopische Aufnahme rechts zeigt eine CAR-NK-Zelle (N; markiert durch das fluoreszierende Markerprotein EGFP), die eine Tumorzelle (T) spezifisch abtötet. DAPI: Anfärbung des Zellkerns (Quelle: Georg-Speyer-Haus).
Die in der Studie weltweit erstmalig in Patienten eingesetzten NK-92/5.28.z Zellen wurden von einem Team von Grundlagenforschern unter Leitung von Prof. Winfried Wels am Georg-Speyer-Haus in Frankfurt in enger Kooperation mit Prof. Torsten Tonn am Institut für Transfusionsmedizin und Immunhämatologie Frankfurt entwickelt und werden für die klinische Studie am Institut für Immunhämatologie und Transfusionsmedizin in komplexen Herstellungsprozessen unter Beachtung der strengen regulatorischen Vorgaben der zuständigen Aufsichtbehörden als Arzneimittel hergestellt. Die der klinischen Studie vorausgegangenen präklinischen Untersuchungen wurden gemeinsam mit Wissenschaftlern vom Dr. Senckenbergischen Institut für Neuroonkologie und dem Edinger Institut durchgeführt, finanziert aus Mitteln des BMBF-geförderten Clusters für individualisierte Immunintervention (Ci3) und des LOEWE-Zentrums für Zell- und Gentherapie (CGT) Frankfurt. Die klinische Studie ist zudem ein wichtiger Beitrag des Standorts zu den Aktivitäten des Deutschen Konsortiums für Translationale Krebsforschung (DKTK).