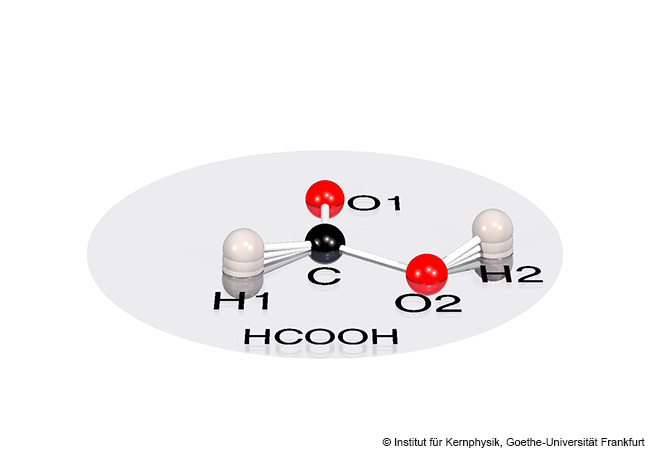
Chemische Bindungen innerhalb des Augenlinsen-Proteins Gamma-B-Kristallin halten das Protein zusammen und sind deshalb wichtig für die Funktion des Eiweißes in der Linse. Entgegen bisheriger Annahmen entstehen bestimmte dieser Bindungen, sogenannte Disulfidbrücken, bereits parallel zur Synthese des Proteins in der Zelle. Dies haben Wissenschaftlerinnen und Wissenschaftler der Goethe-Universität Frankfurt, des Frankfurter Max-Planck-Instituts für Biophysik und des französischen Institute de Biologie Structurale in Grenoble herausgefunden.
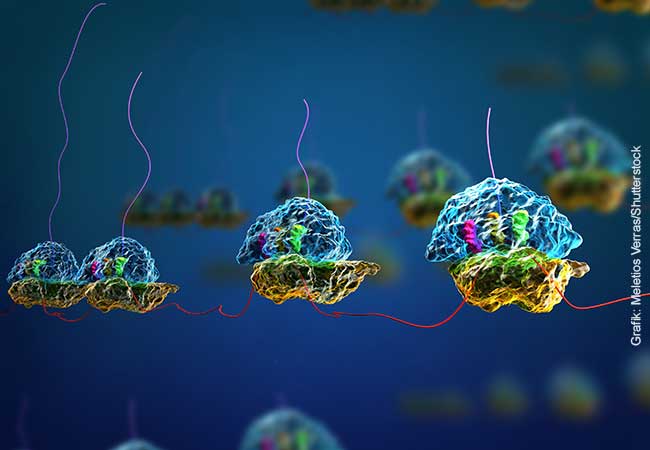
Die Linse des menschlichen Auges erhält ihre Transparenz und Brechkraft dadurch, dass in ihren Zellen bestimmte Proteine dicht gepackt sind. In der Hauptsache handelt es sich dabei um Kristalline. Kann diese dichte Packung zum Beispiel durch erblich bedingte Veränderungen in den Kristallinen nicht aufrechterhalten werden, sind Linsentrübungen die Folge, sogenannte Katarakte („Grauer Star“), die weltweit die häufigste Ursache für den Verlust des Sehvermögens darstellen.
Damit Kristalline in den Linsenfaserzellen dicht gepackt werden können, müssen sie stabil und richtig gefaltet werden. Die Proteinfaltung beginnt bereits während der Biosynthese von Proteinen in den Ribosomen, großen Eiweißkomplexen. Ribosomen helfen dabei, den genetischen Code in eine Abfolge von Aminosäuren zu übersetzen. Dabei bilden Ribosomen einen schützenden Tunnel um die neue Aminosäurekette, die gleich nach der Entstehung dreidimensionale Strukturen mit verschiedenen Elementen wie Helices oder gefalteten Strukturen annimmt. Die in Frankfurt und Grenoble untersuchten Gamma-B-Kristalline weisen darüber hinaus noch viele Verbindungen zwischen je zwei schwefelhaltigen Aminosäuren auf, so genannte Disulfidbrücken.
Die Herstellung solcher Disulfidbrücken ist für die Zelle nicht ganz einfach, herrschen doch im Zellmilieu biochemische Bedingungen, die solche Disulfidbrücken verhindern oder auflösen. Im fertigen Gamma-B-Kristallin-Protein werden die Disulfidbrücken daher durch andere Teile des Proteins nach außen abgeschirmt. Solange das Protein allerdings im Entstehen ist, ist das noch nicht möglich.
Doch weil der Ribosomentunnel als zu eng galt, nahm man – auch aufgrund von anderen Studien – an, dass die Disulfidbrücken der Gamma-B-Kristalline erst nach der Fertigstellung der Proteine entstehen. Zur Prüfung dieser Annahme nutzten die Forscher aus Frankfurt und Grenoble genetisch veränderte Bakterienzellen als Modellsystem, stoppten die Synthese der Gamma-B-Kristalline zu verschiedenen Zeitpunkten und untersuchten die Zwischenprodukte mit massenspektrometrischen, kernspinresonanzspektroskopischen und elektronenmikroskopischen Methoden, ergänzt um theoretische Simulationsrechnungen. Das Ergebnis: Die Disulfidbrücken entstehen bereits am noch nicht fertigen Protein während der Synthese der Aminosäurekette.
„Wir konnten damit zeigen, dass Disulfidbrücken bereits im Ribosomentunnel entstehen können, der genügend Raum dafür bietet und die Disulfidbrücken gegen das zelluläre Milieu abschirmt“ sagt Prof. Harald Schwalbe vom Institut für Organische Chemie und Chemische Biologie der Goethe-Universität. „Überraschenderweise handelt es sich jedoch nicht um dieselben Disulfidbrücken, die später im fertigen Gamma-B-Kristallin vorhanden sind. Wir schließen daraus, dass zumindest einige der Disulfidbrücken später wieder aufgelöst und anders geknüpft werden. Der Grund dafür liegt wahrscheinlich im optimalen Timing der Proteinherstellung: Die ‚vorläufigen‘ Disulfidbrücken beschleunigen die Bildung der ‚finalen‘ Disulfidbrücken, wenn das Gamma-B-Kristallin vom Ribosom freigesetzt wird.“
In weiteren Untersuchungen wollen die Forscher nun testen, ob die Syntheseprozesse in den leicht unterschiedlichen Ribosomen höherer Zellen ähnlich wie im bakteriellen Modellsystem ablaufen.
Publikation: Linda Schulte, Jiafei Mao, Julian Reitz, Sridhar Sreeramulu, Denis Kudlinzki, Victor-Valentin Hodirnau, Jakob Meier-Credo, Krishna Saxena, Florian Buhr, Julian D. Langer, Martin Blackledge, Achilleas S. Frangakis, Clemens Glaubitz, Harald Schwalbe: Cysteine oxidation and disulfide formation in the ribosomal exit tunnel. Nature Communications https://doi.org/10.1038/s41467-020-19372-x