Der kleine Fadenwurm Caenorhabditis elegans meidet das Licht. Zwar besitzt er keine Augen, dafür jedoch in bestimmten Zellen ein Protein namens LITE-1. Es warnt ihn vor der Sonne, deren Strahlen für das Tier gefährlich sind. Die Struktur von LITE-1 hat jetzt ein Wissenschaftsteam von der Goethe-Universität Frankfurt, dem Max-Planck-Institut für Biophysik und dem Flatiron Institute der Simons Foundation in New York aufgeklärt: LITE-1 ist eine gänzlich neue Art eines lichtgesteuerten Ionenkanals. Anstelle von biochemischen Experimenten nutzten die Forscher:innen eine künstliche Intelligenz zur Strukturaufklärung und überprüften das Strukturmodell mit biologischen Experimenten.
In einem Komposthaufen findet der Fadenwurm Caenorhabditis elegans einen reich gedeckten Tisch: Der nur einen Millimeter lange Wurm ernährt sich von Bakterien, die organisches Material zersetzen. Das Sonnenlicht muss das Tier dabei strikt meiden, nicht nur damit es in seinem Temperaturoptimum bleibt und nicht austrocknet. Blaues Licht und UV-Licht sind energiereich und richten in den Zellen des durchsichtigen Wurms großen Schaden an: Das Erbmolekül DNA kann mutieren, oder es entstehen reaktive Sauerstoffverbindungen wie Wasserstoffperoxid (H2O2), die zum Beispiel die korrekte Herstellung von Proteinen verhindern und Zellen in den Tod treiben können. Im Labor lässt sich daher beobachten, dass Caenorhabditis elegans reflexartig vor einem Lichtkegel zurückweicht.
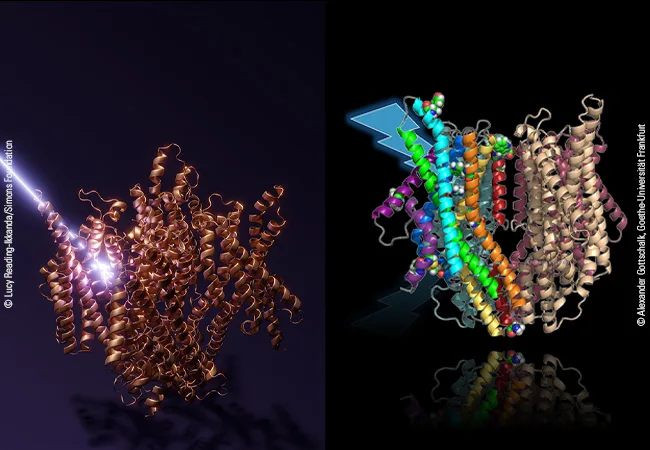
Augen besitzt der Fadenwurm nicht, er verfügt jedoch in einigen sensorischen Nervenzellen über das Protein LITE-1. Es setzt auf bislang unbekannte Weise Lichtsignale in biochemische Signale um, die letztlich die Fluchtbewegung auslösen. Struktur und Funktionsweise von LITE-1 haben jetzt Wissenschaftler:innen um Prof. Alexander Gottschalk von der Goethe-Universität Frankfurt, Prof. Gerhard Hummer vom Max-Planck-Institut für Biophysik sowie der Goethe-Universität und Dr. Sonya Hanson vom Flatiron Institute in New York aufgeklärt. Dafür nutzte das Wissenschaftsteam die Software „AlphaFold2-Multimer“, eine künstliche Intelligenz, die Struktur von Proteinen und Proteinkomplexen anhand der Abfolge ihrer Aminosäure-Bausteine vorhersagen kann. Das Ergebnis: LITE-1 ist ein Protein in der Zellmembran, das eine Art Pore bildet, durch die geladene Teilchen – Ionen –die Membran passieren können, ein sogenanntes Kanalprotein.
„Die KI hat wirklich sehr gut funktioniert und eine plausible Struktur für LITE-1 vorgeschlagen“, sagt Alexander Gottschalk. „In genetischen Experimenten haben wir dann überprüft, ob Vorhersagen, die sich aus dieser Struktur ergeben, sich auch bei Untersuchungen des Fadenwurms und seiner Reaktion auf Licht wiederfinden lassen.“ Dazu schalteten die Forscher:innen gezielt einzelne Strukturelemente in LITE-1 aus und beobachteten die Folgen auf das lichtinduzierte Verhalten. So führten unter anderem der Austausch von Aminosäuren, die den Kanal bilden, zu einem kompletten Funktionsverlust von LITE-1. Weitere Mutationsexperimente zeigten Stellen auf, an denen das Protein mit H2O2 wechselwirken könnte und offenbarten eine zentrale Aminosäure, die offenbar für die Aufnahme von Energie durch UV-Licht verantwortlich ist.
Gerhard Hummer erläutert: „Es scheint, als ob LITE-1 ein ganzes Netzwerk an Aminosäuren enthält, die ausgerichtet sind wie Antennen, um die Energie der UV-Photonen aufzufangen und an eine zentrale Position im Protein weiterzuleiten. Dort befindet sich ein Hohlraum, der als Bindetasche für ein Molekül dienen könnte, das Photonen beziehungsweise deren Energie aufnehmen kann, ein sogenanntes Chromophor.“ Dem Modell der Forscher:innen zufolge wird dieses noch unbekannte Chromophor zusätzlich von blauem Licht direkt angeregt und überträgt die gesamte Energie dann auf das LITE-1-Protein, was zur Öffnung des Ionenkanals und dem Einströmen von Ionen in die Zelle führt. Die höhere Ionenkonzentration ist der Startpunkt für ein biochemisch-elektrisches Signal, das schließlich den Fluchtreflex auslöst.
Dabei spielt offenbar eine Rolle, ob auch durch das Licht gebildetes H2O2 in den Zellen vorhanden ist, so Alexander Gottschalk: „Die zusätzliche Aktivierung von LITE-1 durch H2O2 stellt sicher, dass der Fluchtreflex nicht von schwachem Licht ausgelöst wird, sondern nur von sehr intensivem, gewebeschädigendem Licht wie direkter Sonnenstrahlung.“
LITE-1 stellt eine sehr einfache Form der Lichtwahrnehmung dar. Vergleiche mit Geruchsrezeptoren von Insekten legen nahe, so Gottschalk, dass LITE-1 von einem solchen Geruchsrezeptor abstammt, der vielleicht zufällig ein Molekül gebunden habe, das auch Licht absorbieren konnte und damit zusätzlich zu einem unangenehmen Geruch auch ein Warnsignal vor schädlichem Licht weitergegeben habe.
Gottschalk unterstreicht die Bedeutung dieses Rezeptors auch für das Forschungsgebiet der mit der Entdeckung und Beschreibung des ersten lichtabhängigen Ionenkanals – eines Kanalrhodopsins – in Frankfurt mitbegründeten Optogenetik, also der Möglichkeit, zur Untersuchung zellulärer Funktionen lichtgesteuerte Schalter in Zellen einzusetzen: „LITE-1 und ähnliche Proteine, die wir ebenfalls analysiert haben, lassen sich als neue optogenetische Werkzeuge einsetzen, mit denen wir das Spektrum in den UV-Bereich erweitern können.“ Die Bioinformatikerin Sonya Hanson sieht in der Forschungsmethodik großes Potenzial für die Zukunft: „Die von uns eingesetzte KI ist inzwischen so gut, dass wir möglicherweise künftig auch bei anderen Proteinen auf aufwändige biochemische Arbeit verzichten können, zumindest um eine Idee zu erhalten, wie ein bestimmtes Protein funktioniert.“
Publikation: Sonya M. Hanson, Jan Scholüke, Jana Liewald, Rachita Sharma, Christiane Ruse, Marcial Engel, Christina Schüler, Annabel Klaus, Serena Arghittu, Franziska Baumbach, Marius Seidenthal, Holger Dill, Gerhard Hummer, Alexander Gottschalk: Structure-function analysis suggests that the photoreceptor LITE-1 is a light-activated ion channel. Current Biology (2023), https://doi.org/10.1016/j.cub.2023.07.008













