Lange als besiegt geglaubte Infektionskrankheiten kehren heute zurück, weil ihre Erreger gegen Antibiotika resistent geworden sind. An der Goethe-Universität suchen Forscherinnen und Forscher aus unterschiedlichen Fachdisziplinen nach Lösungen. In den vergangenen Monaten haben eine Reihe von Studien hierzu neue Erkenntnisse geliefert.
Lange Zeit sah es so aus, als ob der Mensch den Kampf gegen Infektionskrankheiten endgültig gewonnen hätte. Nachdem mit Penicillin der Startschuss für die Antibiotikaentwicklung gefallen war, kam bis in die 1970er Jahre eine Vielzahl an Wirkstoffen mit unterschiedlichen Wirkprinzipien auf den Markt. Von Bakterien ausgelöste, zuvor oftmals tödliche Krankheiten wie Tuberkulose oder Lungeninfektionen verloren plötzlich ihren Schrecken. Heute kehrt die Angst vor ihnen zurück, denn der übermäßige Einsatz in Kombination mit weltweiter Migration und Reisetätigkeit hat die einstmals scharfe Waffe der Antibiotika stumpf werden lassen: Immer mehr Erreger erwerben Eigenschaften, die sie unempfindlich gegen antibiotische Wirkstoffe machen. Solche Resistenzen entstehen durch zufällige Mutationen, die dem Träger in Anwesenheit des entsprechenden Antibiotikums einen Überlebensvorteil verleihen. Das resistente Bakterium kann sich vermehren und die nützliche Mutation an die nächste Generation weitergeben. Hinzu kommt, dass Bakterien genetische Information – und damit auch Resistenzen – selbst über Artgrenzen hinweg austauschen können. Manche Erreger erwerben Resistenzen besonders leicht und sind dann kaum noch zu bekämpfen. Wissenschaftlerinnen und Wissenschaftler befürchten deshalb, dass wir auf ein postbiotisches Zeitalter, in dem viele Infektionskrankheiten nicht mehr behandelbar sind, zusteuern.
Für die Pharmaindustrie uninteressant
Um dieses Szenario abzuwenden, ist es dringend notwendig, neue Antibiotika zu entwickeln, insbesondere solche mit neuartigen Wirkmechanismen, gegen die mit großer Wahrscheinlichkeit noch keine Resistenzen im Umlauf sind. Aber genau hier liegt ein weiteres Problem: Für die Pharmaindustrie ist die langwierige und kostenintensive Entwicklung von Antibiotika wenig attraktiv, da sich mit ihnen kaum Gewinne erzielen lassen. Das liegt einerseits daran, dass Antibiotika meist nur kurzzeitig eingesetzt werden müssen. Zum anderen bleiben neuartige Antibiotika als Reserveantibiotika der Behandlung von Infektionen vorbehalten, die durch multiresistente Erreger verursacht werden. So sinnvoll diese Maßnahme ist, möchte kein Unternehmen gerne in die Entwicklung eines Medikaments investieren, das nachher nur selten verschrieben werden darf. Hier ist die universitäre Forschung im Vorteil, weil sie weniger gewinnorientiert arbeiten muss. An der Goethe-Universität Frankfurt hat die Resistenzforschung einen hohen Stellenwert. Neue Ansätze kommen dabei aus ganz unterschiedlichen Fachbereichen wie Medizin, Biologie und Chemie.
Den Erstkontakt unterbinden
Am Institut für Medizinische Mikrobiologie und Infektionskontrolle setzt Prof. Volkhard Kempf mit seinem Team am ersten Schritt der bakteriellen Infektion an – der sogenannten Adhäsion. Um einen Wirt erfolgreich zu infizieren, muss sich ein Erreger zuerst an dessen Gewebe anheften können. Hierfür verwendet er z. B. sogenannte Adhäsine, also Strukturen auf seiner Oberfläche, die spezifisch Oberflächenkomponenten der Zielzellen erkennen und binden. Nur wenn dem Erreger diese Ansiedlung gelingt, kann er sich vermehren und eine Infektion verursachen. Wie die Adhäsion auf molekularer Ebene funktioniert, haben die Forscherinnen und Forscher um Kempf in einer aktuellen Studie in Kooperation mit Matthias Leisegang vom Institut für Kardiovaskuläre Physiologie und weiteren Forscherinnen und Forschern aus Münster, Tübingen, Schweden und Norwegen am Beispiel des Erregers der Katzenkratzkrankheit, Bartonella henselae, aufgeklärt. Die Krankheit kann von Katzen auf den Menschen übertragen werden und äußert sich dort als fiebrige Infektion mit Lymphknotenschwellung. Die Krankheit habe einen verhältnismäßig milden Verlauf, sei aber sehr verbreitet, erklärt Kempf: „Zwischen fünf bis zehn Prozent der Menschen in Deutschland haben Antikörper gegen den Erreger im Blut, müssen sich also irgendwann infiziert haben. Jedes Jahr kommen allein in Deutschland ca. 7500 neue Infektionen hinzu.“

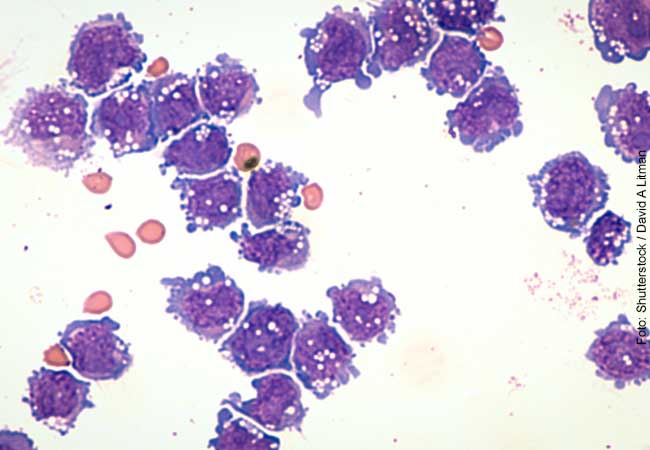
Marseille) Bakterien (hellblau) in einem frühen Stadium der Infektion (30 Minuten) an menschlichen HeLa-229-Zellen (rot). Die Adhäsion an Wirtszellen wird durch spezifische Wechselwirkungen zwischen B. henselae-Oberflächenproteinen und Komponenten der extrazellulären Matrix des Wirts, einschließlich Molekülen wie Fibronektin oder Kollagen, vermittelt. Maßstabsbalken: 8 μm.
Der vergleichsweise harmlose Erreger dient als Modell für eine Gruppe von Bakterien, zu denen gefährliche Keime gehören: die sogenannten gramnegativen Bakterien. Diese benutzen zu einem großen Teil eine bestimmte Sorte von Adhäsinen, die das menschliche Eiweiß Fibronektin binden. Letzteres befindet sich unter anderem auf der Oberfläche von Epithelzellen, die die inneren und äußeren Körperoberflächen bedecken. Damit bietet sich den gramnegativen Bakterien die Möglichkeit, ganz verschiedene Organe zu besiedeln.
Um herauszufinden, wie Adhäsin und Fibronektin aneinander binden, hat das Team um Kempf die Bindung der beiden Partner zuerst chemisch fixiert und den Komplex daraufhin in kleine Bruchstücke zerlegt. Deren Aminosäureabfolge ließ sich dann mithilfe von Hochdurchsatz-Technologien bestimmen. „Auf diese Weise konnten wir erstmals zeigen, welche Aminosäuren für die Bindung verantwortlich sind“, freut sich Kempf. Die Daten erlauben nun, nach Wirkstoffkandidaten zu suchen, die das Andocken der Adhäsine an Fibronektin verhindern. Ein wichtiger Schritt hierzu wurde schon gemacht, wie Kempf ausführt: „Mithilfe von spezifischen Antikörpern gegen einzelne Abschnitte der Adhäsine konnten wir die Interaktion mit Fibronektin fast vollständig blockieren.“
Die Achillesferse finden
Wirkstoffe, die die Adhäsine blockieren, würden nicht nur Infektionen durch B. henselae, sondern auch durch andere gramnegative Krankheitserreger verhindern. Einer davon ist Acinetobacter baumannii, der vor allem vorerkrankte und immungeschwächte Patienten besiedeln kann. Schätzungen zufolge gehen bis zu fünf Prozent aller im Krankenhaus erworbenen Infektionen alleine auf diesen Erreger zurück. Das ist besonders besorgniserregend, weil A. baumannii aufgrund eines flexiblen Genoms Resistenzen leicht aufnimmt.
Infektionen mit multiresistenten A. baumannii-Stämmen nehmen inzwischen auch außerhalb des Krankenhausumfelds zu, während gleichzeitig die Krankheitsverläufe tendenziell immer schwerer werden. Die Weltgesundheitsorganisation (WHO) hat A. baumannii deshalb als „Priorität 1“-Erreger zur Erforschung neuer Antibiotika klassifiziert. Ein Grund für Ingo Ebersberger vom Institut für Zellbiologie und Neurowissenschaften und vom LOEWE-Zentrum für Translationale Biodiversitätsgenomik (LOEWE-TBG), sich mit seinem Team auf die Suche nach einer Achillesferse des Erregers zu machen. Dazu hat der Bioinformatiker gezielt pathogene Vertreter der Bakteriengattung Acinetobacter wie A. baumannii mit nahen Verwandten verglichen, die als harmlose Umweltbakterien in Gewässern, auf Pflanzen oder Tieren leben. Der Vergleich ihrer Genome lässt Rückschlüsse darauf zu, welche Eigenschaften aus einem harmlosen Umweltbakterium ein hochgefährliches Pathogen machen.
Neue Zielorte für Antibiotika
In ihrer Analyse konzentrierten sich Ebersberger und Kolleg*innen auf Gruppen benachbarter Gene, die im Verlauf der Evolution als Einheit stabil geblieben sind und deshalb vermutlich eine funktionelle Einheit bilden. In solchen Genclustern sind bei Bakterien beispielsweise alle Gene zusammengefasst, die für die Synthese eines bestimmten Naturstoffs benötigt werden. „Von diesen evolutionär stabilen Genclustern haben wir 150 gefunden, die bei pathogenen Acinetobacter-Stämmen vorkommen und bei ihren nichtpathogenen Verwandten weitgehend fehlen“, fasst der Bioinformatiker zusammen. „Bei ihnen ist die Wahrscheinlichkeit hoch, dass sie den Krankheitserregern einen Überlebensvorteil im menschlichen Wirt verschaffen.“
Tatsächlich stießen die Frankfurter dabei auf Eigenschaften, von den schon bekannt war, dass sie die Pathogenität fördern. Dazu gehört die Fähigkeit, Biofilme zu bilden, in denen Keime durch eine dicke Schleimschicht vor schädlichen Einflüssen wie Antibiotika oder dem Immunsystem geschützt sind. Auch Mikronährstoffe wie Eisen und Zink, die im menschlichen Wirt knapp sind, kann A. baumannii durch eine Vielzahl von Transportern wohl besser aufnehmen als seine harmlosen Verwandten. Neu ist die Entdeckung, dass der Keim einen vom menschlichen Immunsystem gebildeten Botenstoff als Energiequelle nutzen kann. Durch dessen Abbau wird gleichzeitig die Immunantwort im Sinne des Bakteriums verändert. „Unsere Arbeit ist ein Meilenstein im Verständnis, was pathogene Acinetobacter baumannii ausmacht“, ist Ebersberger überzeugt. „Dieses Wissen können wir jetzt nutzen, um spezifische Therapien zu entwickeln, gegen die mit großer Wahrscheinlichkeit noch keine Resistenzen existieren.“
Bekanntes verbessern
Die Arbeiten von Kempf und Ebersberger liefern wichtige Ansatzpunkte für die Entwicklung von Antibiotika mit neuen Wirkprinzipien. Bis letztere beim Menschen zum Einsatz kommen können, müssen jedoch noch viele Hürden genommen werden. Parallel zur Suche nach neuen Antibiotika ist es deshalb sinnvoll, bereits bekannte weiterzuentwickeln. Eine Strategie hierzu ist das Einfügen von Fluoratomen in die Antibiotikamoleküle, wie sie Martin Grininger vom Institut für Organische Chemie und Chemische Biologie mit seiner Arbeitsgruppe praktiziert. In Zusammenarbeit mit David Sherman von der University of Michigan ist es Grininger und seinem Team nun gelungen, eine besonders schonende Methode zu entwickeln, um das Antibiotikum Erythromycin zu fluorieren. Erythromycin wirkt als Breitbandantibiotikum gegen eine Vielzahl von Krankheitserregern, indem es ihre Proteinproduktion lahmlegt. Es wird biotechnologisch in Bakterien hergestellt. Bisherige Verfahren hatten Fluoratome nach der Synthese durch aufwändige und teils brachiale chemische Verfahren eingefügt. Griningers Methode setzt dagegen schon bei der Synthese an: Die Chemikerinnen und Chemiker konstruierten einen Bakterienstamm, der in der Lage ist, einen fluorierten Ausgangsstoff direkt ins Erythromycin einzubauen. Durch die Wahl des Ausgangsstoffs lassen sich unterschiedlich fluorierte Antibiotikavarianten herstellen.
Und auch andere Naturstoffmedikamente, die wie Erythromycin zur Stoffklasse der sogenannten Polyketide gehören, sollten sich so verändern lassen – ein riesiges Anwendungspotenzial, das das von Griningers ehemaligem Mitarbeiter Alexander Rittner gegründete Startup-Unternehmen kez.biosolutions GmbH ausschöpfen soll. „Die erfolgreiche Fluorierung von Erythromycin ist ein Durchbruch, für den wir viel getan haben und auf den ich jetzt sehr stolz bin“, sagt Grininger. „Wir arbeiten bereits daran, die antibiotische Wirkung verschiedener fluorierter Erythromycin-Verbindungen und weiterer fluorierter Polyketide zu testen und werden die neue Technologie auf weitere Fluormotive ausweiten.“
Globaler Bedrohung gemeinsam begegnen
Antibiotikaresistenzen reisen mit ihren Trägern um die Welt und sind deshalb ein globales Problem, das nur durch internationale Zusammenarbeit bekämpft werden kann. Während in den Industrieländern an neuen Antibiotika geforscht wird, ist aber in vielen Entwicklungsländern die Datenlage zur Verbreitung von Resistenzen noch sehr dünn. Gezielte Gegenmaßnahmen sind so schwer möglich. Die Goethe-Universität hat deshalb gemeinsam mit kenianischen Forscherinnen und Forschern in einer vom Bundesministerium für Bildung und Forschung (BMBF), der Gesellschaft für internationale Zusammenarbeit sowie dem LOEWE-Zentrum DRUID („Novel Drug Targets against Poverty-related and Neglected Tropical Infectious Diseases“) geförderten Studie bei 300 Müttern und ihren Säuglingen auf der Neugeborenen-Intensivstation des Kenyatta-Hospitals in Nairobi vier Monate lang nach resistenten gramnegativen Erregern gesucht. Das Ergebnis ist alarmierend: In 1000 Proben fanden sich 288 resistente Erreger, von denen 63 sogar gegen Reserveantibiotika aus der Gruppe der Carbapeneme unempfindlich waren. Bei der Entlassung aus dem Krankenhaus trug fast die Hälfte der Kinder resistente Erreger mit sich, die das Potenzial hatten, sich in der Bevölkerung auszubreiten. Volkhard Kempf, der die Studie gemeinsam mit Moses Masika vom Kenyatta Hospital geleitet hat, zieht ein positives Fazit der deutsch-afrikanischen Kollaboration: „Die Zusammenarbeit mit unseren kenianischen Kolleginnen und Kollegen hat hervorragend funktioniert.“ In einem Folgeprojekt sollen nun weitere Bevölkerungsgruppen untersucht werden. „Denn je mehr wir über die Entstehung und Ausbreitung von Resistenzen wissen, desto leichter können wir ihnen den Kampf ansagen.“
Larissa Tetsch