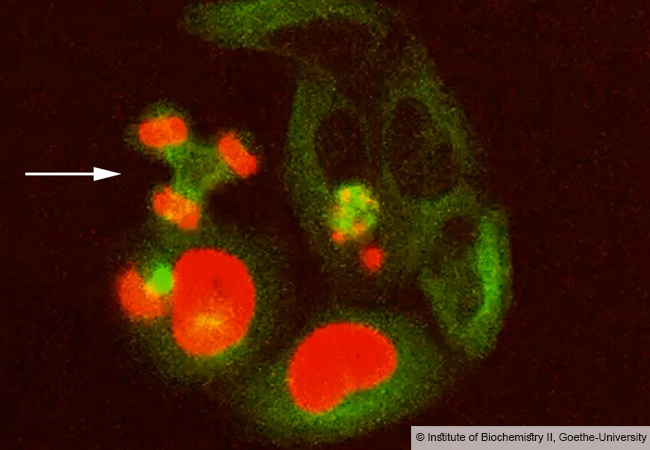
Die Kraftwerke höherer Zellen, die Mitochondrien, waren ursprünglich eigenständige Lebewesen. Wie sehr sich ihr Stoffwechsel im Laufe der Evolution mit dem ihrer Wirtszellen verschränkt hat, haben Wissenschaftler:innen der Goethe-Universität Frankfurt am Beispiel einer Stressreaktion von Mitochondrien untersucht. Sie fanden heraus, dass die Mitochondrien zwei unterschiedliche biochemische Signale senden. Diese werden in der Zelle miteinander verarbeitet und starten ein Unterstützungsprogramm, um das zelluläre Gleichgewicht (Homöostase) wiederherzustellen. Die Arbeiten wurden unter anderem im Rahmen der Clusterinitiative ENABLE (fortgeführt als EMTHERA) der Goethe-Universität gemacht.
Als das Leben sich auf unserer Erde in Form verschiedenster einzelliger Lebewesen verbreitete, gelang einem dieser Einzeller irgendwann vor 3,5 bis einer Milliarde Jahren ein evolutionärer Coup: Statt Bakterien zu fressen und zu verdauen, kapselte es seine Beute ein und nutzte sie als Energielieferant. Im Gegenzug bot es als Wirtszelle Schutz und Nahrung. Dieser sogenannten Endosymbionten-Theorie zufolge war jener Einzeller die Urmutter aller höheren Zellen, aus denen sich alle Tiere, Pilze und Pflanzen entwickelten. Im Laufe der Jahrmilliarden wurde das eingeschlossene Bakterium zum Kraftwerk der Zelle, dem Mitochondrium, das ihr die zelluläre Energieeinheit ATP liefert. Es verlor einen Großteil seiner Erbsubstanz DNA und tauschte kleinere DNA-Abschnitte mit der Mutterzelle aus. Nach wie vor teilen sich Mitochondrien jedoch unabhängig von der Zelle und besitzen eine Reihe eigener Gene.
Wie eng Zelle und Mitochondrium heute in menschlichen Zellen zusammenarbeiten, untersucht ein Wissenschaftsteam um Dr. Christian Münch von der Goethe-Universität. Die Forscher:innen haben jetzt entdeckt, auf welche Weise das Mitochondrium Unterstützung durch die Zelle anfordert, wenn es unter Stress gerät. Auslöser für solchen Stress können zum Beispiel Infektionen, Entzündungsvorgänge oder genetische Störungen sein, aber auch Nährstoffmangel oder Zellgifte.
Eine bestimmte Form des mitochondrialen Stresses wird durch falsch gefaltete Proteine hervorgerufen, die nicht rasch abgebaut werden und sich im Mitochondrium ansammeln. Die Folgen für das Mitochondrium wie für die Zelle sind dramatisch: Fehlgefaltete Proteine können zum Beispiel die Energieproduktion stören oder zur Bildung größerer Mengen sogenannter reaktiver Sauerstoffverbindungen führen, die die Mitochondrien-DNA angreifen und weitere Fehlfaltungen von Proteinen zur Folge haben. Auch können fehlerhaft gefaltete Proteine die Mitochondrien-Membranen destabilisieren, sodass Signalstoffe aus dem Mitochondrium freigesetzt werden, die das Selbstzerstörungsprogramm „Apoptose“ der Zelle anschalten.
Daher reagiert das Mitochondrium auf den Stress, indem es vermehrt Protein-Faltungshelfer (Gouvernanten-Proteine) herstellt, um die Fehlfaltungen zu verringern, sowie Protein-Schreddereinheiten, die die fehlgefalteten Proteine abbauen. Wie Zellen dieses Schutzprogramm starten, war bisher unbekannt.
Die Forschenden der Goethe-Universität lösten in den Mitochondrien kultivierter menschlicher Zellen den Fehlfaltungsstress künstlich aus und analysierten die Folgen. „Die Schwierigkeit in der Aufklärung solcher Signalprozesse besteht darin,“ erläutert der Biochemiker Münch, „dass unglaublich viele gleichzeitig und mit hoher Geschwindigkeit in der Zelle ablaufen.“ Das Wissenschaftsteam nutzte daher Methoden (Transkriptom-Analysen), mit denen sich im Zeitverlauf messen lässt, wie stark Gene abgelesen werden. Außerdem beobachteten die Forscher:innen unter anderem, welche Proteine zu welchem Zeitpunkt aneinander binden, in welchen Zeiträumen sich die Konzentrationen innerzellulärer Stoffe ändern und welche Auswirkungen das gezielte Ausschalten einzelner Proteine hat.
Das Ergebnis: Bei Protein-Fehlfaltungsstress senden Mitochondrien zwei chemische Signale an die Zelle: Sie setzen reaktive Sauerstoffverbindungen frei und blockieren den Import von Protein-Vorstufen, die in der Zelle hergestellt und erst im Inneren des Mitochondriums in ihre funktionale Form gebracht werden. Dadurch reichern sich diese – ungefalteten – Vorstufen in der Zelle an. Die reaktiven Sauerstoffverbindungen führen unter anderem zu chemischen Veränderungen an einem Protein namens DNAJA1. DNAJA1 unterstützt in der Zelle normalerweise einen bestimmten Faltungshelfer (Gouvernantenprotein, englisch: chaperone), der die neu entstehenden Proteine der Zelle in die richtige Form bringt.
Als Folge der chemischen Veränderung drängt sich DNAJA1 nunmehr verstärkt dem Faltungshelfer HSP70 als Assistenz auf. HSP70 kümmert sich daraufhin besonders um die fehlgefalteten Protein-Vorstufen, die sich wegen des Importstopps rund um das Mitochondrium ansammeln. Durch verringert HSP70 seine Interaktion mit seinem regulären Partner HSF1. Der wiederum wird nun freigesetzt, kann ins Innere des Zellkerns wandern und dort das Anti-Stressprogramm für das Mitochondrium starten.
Der Biochemiker Münch erklärt: „Es war sehr spannend herauszufinden, wie die beiden Stress-Signale des Mitochondriums in der Zelle zu einem Signal zusammengeführt werden, das dann das Antwortprogramm der Zelle auf den mitochondrialen Stress startet. Außerdem greifen bei diesem komplexen Prozess, der wesentlich durch winzige lokale Konzentrationsänderungen getrieben wird, die Stress-Signalwege der Zelle und des Mitochondriums sehr elegant ineinander wie ein perfektes Uhrwerk.“
Publikation: F.X. Reymond Sutandy, Ines Gößner, Georg Tascher, Christian Münch: A cytosolic surveillance mechanism activates the mitochondrial UPR. Nature (2023) https://doi.org/10.1038/s41586-023-06142-0
Hintergrundinformation
Fehlfaltung in Mitochondrien: Emmy-Noether-Stipendium der Deutschen Forschungsgemeinschaft für Christian Münch
Das Clusterprojekt EMTHERA (Emerging Therapies) sucht nach neuen Ansätzen zur Erforschung von Infektions- und Entzündungskrankheiten sowie Störungen des Immunsystems und zur Entwicklung neuartiger Therapien. EMTHERA ist eine Initiative der Rhein-Main-Universitäten (RMU). www.emthera.de/