Langestreckte Fasern (Fibrillen) des Beta-Amyloid-Proteins bilden die typischen senilen Plaques im Gehirn von Alzheimer-Patienten. Einem europäischen Forscherteam ist es jetzt zeitgleich mit einem US-amerikanischen Team gelungen, die Struktur des für die Krankheit bedeutendsten Beta-Amyloid-Peptids 1–42 mit atomarer Auflösung aufzuklären. Dies erleichtert die gezielte Suche nach Arzneistoffen zur Behandlung der Alzheimer-Demenz.
Weltweit sind mindestens 60 Prozent der Demenzerkrankungen auf die Alzheimer-Krankheit zurückzuführen. Sie verursacht enormes menschliches Leid und bringt hohe Kosten mit sich. Heilung oder eine ursächliche Therapie gibt es bis heute nicht. Unter anderem deshalb, weil der genaue Ablauf der Krankheit auf molekularer Ebene im Gehirn noch viele Rätsel aufgibt.
Bekannt ist, dass das Beta-Amyloid-Protein eine entscheidende Rolle spielt. Es handelt sich um ein 39 bis 42 Aminosäuren langes, für Nervenzellen giftiges Peptid, das langgestreckte Fibrillen (Fasern) bilden kann. Beta-Amyloid-Peptid 1–42 und Beta-Amyloid-Peptid 1-40 sind die beiden Hauptformen, die in senilen Plaques vorkommen. Warum diese zum Untergang von Nervenzellen im Gehirn führen, ist nicht bekannt, aber von größtem Interesse für die Entwicklung von Alzheimer-Arzneimitteln.
In einer Zusammenarbeit zwischen der ETH Zürich, der Université de Lyon und der Goethe Universität Frankfurt am Main ist es, in Zusammenarbeit mit Kollegen an der Universität Irvine und dem Brookhaven National Laboratory, jetzt gelungen, den Aufbau einer Fibrille des für die Krankheit gefährlichsten Beta-Amyloid-Peptids 1–42 mit atomarer Auflösung aufzuklären. Die Forscher bauten dabei auf Arbeiten der Universität Chicago über die Struktur von Beta-Amyloid Monomeren auf. Weitere immunologische Untersuchungen wiesen nach, dass die untersuchte Form der Fibrillen besonders krankheitsrelevant ist.
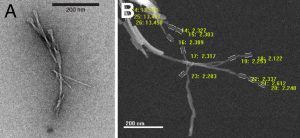
Proteinfibrillen sind in elektronenmikroskopischen Aufnahmen zwar sichtbar (Abb. 1), aber es ist sehr schwierig, ins atomare Detail zu gehen. Die dafür gebräuchlichen strukturbiologischen Methoden setzen voraus, dass das Makromolekül entweder als möglichst regelmäßiger Kristall oder in Form einzelner gelöster Moleküle in Wasser vorliegt. Fibrillen sind jedoch langgestreckte Gebilde, die unter sich verkleben und weder Kristalle bilden noch in Wasser gelöst werden können.
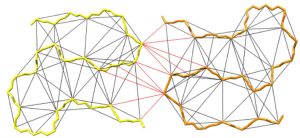
Einzig die Festkörper-Kernresonanzspektroskopie (Festkörper-NMR) ist hier in der Lage, Einblick auf atomarer Ebene zu bieten. Neue methodische Entwicklungen erlauben es, ein Netzwerk von Distanzen zwischen Atomen der Proteinmoleküle in einer Fibrille auszumessen (Abb. 2). Daraus konnte in umfangreichen Rechnungen der atomare Aufbau der Fibrille rekonstruiert werden.
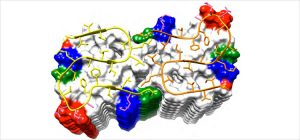
Der Hauptteil des Beta-Amyloid 1–42 Peptids nimmt die Struktur eines doppelten Hufeisens an (Abb. 3). Jeweils zwei gleiche Moleküle in einer Ebene bilden, aufeinandergestapelt, eine lange Fibrille. Viele Wasserstoffbrückenbindungen parallel zur Längsachse geben der Fibrille ihre hohe Stabilität.
„Die Struktur unterscheidet sich grundlegend von früheren Modellstudien, für die kaum experimentelle Messdaten zur Verfügung standen“, erklärt Prof. Peter Güntert, Professor für Computergestützte Strukturbiologie an der Goethe-Universität.
In Fachkreisen haben die Publikationen der europäischen und amerikanischen Teams, die einander bestätigen, für Aufsehen gesorgt, denn erstmals ist es möglich, auf Grundlage der Struktur gezielt nach Arzneistoffen zu suchen, die Beta-Amyloid Fibrillen angreifen. Die Forscher hoffen, dass in den nächsten ein bis zwei Dekaden der vor 110 Jahren von dem Frankfurter Arzt Alois Alzheimer erstmals beschriebenen Geißel des Alters der Schrecken genommen werden kann.
[dt_call_to_action content_size=“small“ background=“fancy“ line=“true“ style=“1″ animation=“fadeIn“]
Publikationen
Wälti, M. A., Ravotti, F., Arai, H., Glabe, C., Wall, J., Böckmann, A., Güntert, P., Meier, B. H. & Riek, R. Atomic-resolution structure of a disease-relevant Aβ(1-42) amyloid fibril. Proceedings of the National Academy of Sciences of the United States of America, DOI 10.1073/pnas.1600749113. http://www.pnas.org/content/early/2016/07/27/1600749113
Colvin, M. T., Silvers, R., Ni, Q. Z., Can, T. V., Sergeyev, I., Rosay, M., Donovan, K. J., Michael, B., Wall, J., Linse, S. & Griffin, R. G. Atomic resolution structure of monomorphic Aβ42 amyloid fibrils. Journal of the American Chemical Society, DOI 10.1021/jacs.6b05129.
Xiao, Y., Ma, B., McElheny, D., Parthasarathy, S., Long, F., Hoshi, M., Nussinov, R. & Ishii, Y. Aβ(1–42) fibril structure illuminates self-recognition and replication of amyloid in Alzheimer’s disease. Nature Structural & Molecular Biology 22, 499–505 (2015).
[/dt_call_to_action]