Alltagstaugliche Wasserstoffspeicherung und die Aussicht auf den Abbau von Kohlendioxid
Diese Entdeckung war fast zu schön, um wahr zu sein: Mitglieder der Arbeitsgruppe von Volker Müller, Leiter der Abteilung Molekulare „Mikrobiologie und Bioenergetik“ an der Goethe-Universität, fanden 2013 ein bemerkenswertes Enzym: die „wasserstoffabhängige CO2-Reduktase“ – nach den Anfangsbuchstaben (der englischen Bezeichnung) auch als HDCR bezeichnet. Als einziges bekanntes Enzym verarbeitet HDCR nichts anderes als die Gase Wasserstoff (H2) und Kohlendioxid (CO2) und bewirkt, dass aus ihnen Ameisensäure entsteht. Oder anders ausgedrückt: HDCR speichert den Wasserstoff in Form von Ameisensäure – diese hat eine ausgesprochen praktische Eigenschaft: Sie ist flüssig. Wasserstoff kann auf diese Weise also sehr viel einfacher und risikoärmer gespeichert, transportiert und zur Energieerzeugung eingesetzt werden, als das mit dem äußerst explosiven Gas H2 möglich wäre. Erst dadurch sollte es realistisch sein, auch im Alltag Wasserstoff als CO2-neutralen Energieträger der Zukunft zu nutzen.
Das Wort „Reduktase“ im Namen des Enzyms weist dabei darauf hin, dass sich bei der Herstellung von Ameisensäure aus H2 und CO2 die elektronische Struktur der beteiligten Atome/Moleküle ändert: Der Wasserstoff gibt Elektronen an ein CO2-Molekül weiter, und an dieser Elektronen-Transaktion sind keine weiteren Überträger-Moleküle beteiligt. Noch zwei andere Eigenschaften zeichnen das Enzym HDCR aus: Zum einen ist der Prozess der Ameisensäureherstellung vollständig umkehrbar – der so gespeicherte Wasserstoff kann letztlich wieder freigesetzt werden und steht damit wieder als Energieträger zur Verfügung.
Zum anderen beschleunigt das Enzym HDCR die Ameisensäureherstellung äußerst effizient: „Die Raten, mit denen CO2 und H2 unter HDCR-Einfluss zu Ameisensäure und zurück reagieren, sind die höchsten je gemessenen“, berichtet Müller, „sie sind um ein Vielfaches größer als bei anderen biologischen oder chemischen Katalysatoren.“ Und anders als beim Einsatz chemischer Katalysatoren komme die Ameisensäureherstellung mittels HDCR ohne teure Edelmetall-Katalysatoren und ohne Extrembedingungen wie hohe Drücke und große Hitze aus, fügt er hinzu.
Unscheinbar, aber entscheidend
Das Enzym HDCR kommt im Zytoplasma verschiedener Bakterien vor: so etwa in dem hitzeliebenden Bakterium Thermoanaerobacter kivui (T. kivui), das unter Luftabschluss beispielsweise im Schlamm des ostafrikanischen Kivu-Sees lebt, ebenso wie in Acetobacterium woodii (A. woodii), das gemäßigte Temperaturen bevorzugt. Als Müller und Mitglieder seiner Arbeitsgruppe vor zehn Jahren begannen, die HDCR im Labor zu untersuchen, stellten sie allerdings fest, das ihrem Einsatz in der praktischen Ameisensäureproduktion (und damit der Speicherung von Wasserstoff) ein auf den ersten Blick unscheinbares, tatsächlich aber entscheidendes Detail im Weg stand: HDCR ist extrem sauerstoffempfindlich, schon winzigste Mengen an Sauerstoff bewirken, dass das Enzym seine Aufgabe bei der Herstellung von Ameisensäure nicht mehr erfüllen kann.
Der Bioreaktor, den Fabian Schwarz jetzt während seiner Doktorarbeit in Müllers Arbeitsgruppe entwickelt hat, umgeht dieses Problem auf ebenso einfache wie elegante Weise: In diesem Bioreaktor wird das Enzym HDCR gar nicht erst aus den Bakterien isoliert, sondern in seiner „natürlichen Umgebung“, dem Zytoplasma der Bakterien, belassen. „Wir stellen unseren Bioreaktor in ‚Joule‘ vor, einem angesehenen Fachmagazin für chemische und physikalische Verfahrenstechnik“, sagt Müller, „und wir demonstrieren, wie er für mehr als zwei Wochen sehr stabil gelaufen ist.“ Dass das Paper der Frankfurter Mikrobiologen in „Joule“ zur Veröffentlichung angenommen wurde, belege die Alltagstauglichkeit des Verfahrens.
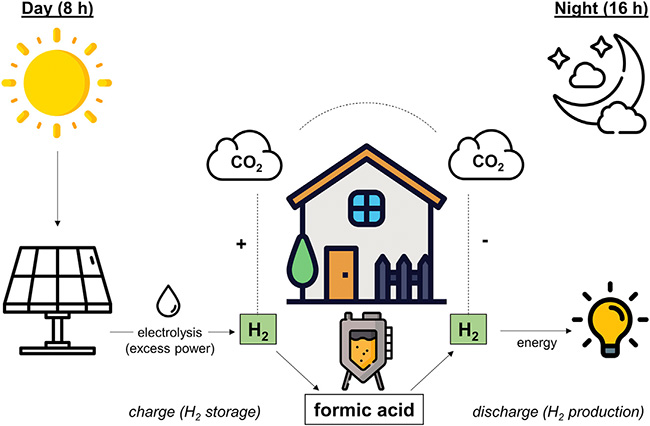
Zu diesem Verfahren gehört, dass die Bakterien des Bioreaktors während einer achtstündigen „Tagphase“ mit Wasserstoff und Kohlendioxid versorgt werden, so dass sie daraus mit Hilfe des Enzyms HDCR Ameisensäure bilden, mit anderen Worten: so dass sie den Wasserstoff in Form von Ameisensäure speichern. Während der folgenden 16-stündigen „Nachtphase“ werden die Bakterien von der Wasserstoffzufuhr abgeschnitten und setzen den Wasserstoff daraufhin vollständig wieder frei.
Wasserstoff aus regenerativen Quellen
Dabei deuten die Bezeichnungen „Tag“ und „Nacht“ schon an, dass dieser nicht mit irgendwelchem Wasserstoff betrieben werden soll, sondern mit nachhaltig produziertem, also „grünem“ Wasserstoff. H2 wird nämlich durch Elektrolyse aus Wasser (H2O) gewonnen: indem man das Wasser „unter Strom setzt“, und dieser Strom stammt im Fall von grünem Wasserstoff aus regenerativen Quellen, wird also typischerweise von Solarzellen in Photovoltaikanlagen erzeugt. Das heißt, der Wasserstoff steht am Tag zur Verfügung – „eben wenn die Sonne scheint“, kommentiert Müller.
Von alleine bleibt es allerdings nicht dabei, dass Ameisensäure entsteht: Normalerweise reagiert Ameisensäure weiter zu Essigsäure – und die Essigsäure kann (anders als Ameisensäure) nicht einfach wieder in die gasförmigen Ausgangsprodukte Wasserstoff (H2) und Kohlendioxid (CO2) zurückverwandelt werden. Durch die Folgereaktion zu Essigsäure würde also ein Teil des gespeicherten Wasserstoffs für die Energieerzeugung verloren gehen; um das zu vermeiden, haben die Forschenden den Bioreaktor mit genetisch veränderten A.woodii-Bakterien betrieben, in denen die Essigsäurebildung unterdrückt ist.
Charakteristisch für den von Schwarz und Müller entwickelten Bioreaktor ist, dass beide Reaktionsrichtungen, sowohl die Bildung von Ameisensäure als auch die Freisetzung von Wasserstoff, in ein und derselben Anlage ablaufen – insbesondere das ist sinnvoll, wenn kommunale Energieversorger und sogar Privathaushalte das Verfahren „auf dem heimischen Balkon“ nutzen wollen. Theoretisch wird dabei während der Tagphase sogar Kohlendioxid aus der Luft entfernt – allerdings wird dieses im Verlauf des Bioreaktorbetriebs (während der Nachtphase) wieder freigesetzt, so dass der CO2-Gehalt der Atmosphäre insgesamt gleich bleibt.
Per Saldo Kohlendioxid aus der Atmosphäre zu entfernen, erscheint allerdings erst jetzt nicht nur Wunschtraum oder Science-Fiction zu sein – die Voraussetzung dafür sind weitere Erkenntnisse aus Müllers Arbeitsgruppe: Nachdem deren Mitglieder das Enzym HDCR entdeckt und bei ersten Untersuchungen herausgefunden hatten, dass schon kleinste Mengen an (Luft-)Sauerstoff ausreichen, es funktionsunfähig zu machen, wandten sie sich nämlich nicht nur der Entwicklung des Bioreaktors zu, also einer möglichen (wichtigen!) Anwendung, die Probleme durch den Einfluss von Sauerstoff ganz einfach umgeht.
Struktur und Funktionsprinzip
Anhand der HDCR des in Ostafrika entdeckten Bakteriums T. kivui untersuchten sie außerdem, wie das Enzym im Einzelnen aufgebaut ist – in der Erwartung, dass seine Struktur ihnen auch etwas über die Funktionsweise verrät. Dabei stellten sie zunächst fest, dass das Enzym HDCR aus vier Modulen besteht: eines, an dem die H2-Moleküle, aus denen gasförmiger Wasserstoff besteht, aufgespalten werden. Dann zwei kleine Module, die jeweils Eisen und Schwefel enthalten. Und schließlich eines, an dem aus Kohlendioxid Ameisensäure gebildet wird.
„Als wir die kleinen Eisen-Schwefel-Untereinheiten gefunden hatten, wussten wir: Sie müssen es sein, die bei der Ameisensäureherstellung Elektronen von einem Teil des Enzyms zum anderen leiten“, sagt Müller, „hier passiert also die Elektronen-Transaktion, die für die Enzym-Aktivität der Reduktase HDCR entscheidend ist.“ Müller, seine Mitarbeiterinnen und Mitarbeiter sowie Forscher aus Marburg und Basel griffen allerdings noch tief in die Trickkiste, um das zu beweisen – dafür wurden sie jetzt mit einer Veröffentlichung im hoch angesehenen Wissenschaftsmagazin „Nature“ belohnt; indem sie die Struktur von HDCR atomgenau aufklärten, fanden die Forscher heraus, wie die Bildung von Ameisensäure im Einzelnen abläuft. Sie ermittelten, wie die Speicherung von Wasserstoff in Form von (flüssiger) Ameisensäure funktioniert und warum sie so effizient abläuft, dass dieser Mechanismus sich als Funktionsprinzip eines alltagstauglichen Bioreaktors eignet.
Nachdem sie die Bakterien und ihre HDCR zunächst noch mit einem konventionellen Elektronenmikroskop betrachtet hatten, untersuchten sie diese nämlich jetzt mittels Kryo-Elektronenmikroskopie: Das ist zwar „einfach“ Elektronenmikroskopie, bei der das Untersuchungsobjekt beispielsweise von flüssigem Stickstoff (-196°C) oder flüssigem Helium (-269°C) gekühlt wird. Aber weil erstens bei diesem Verfahren leistungsfähigere Kameras eingesetzt werden, weil zweitens die Aufnahmen bei tiefen Temperaturen weniger durch die Eigenbewegungen der Atome und Moleküle „verwackeln“ und weil drittens die Mikroskopaufnahmen durch aufwendige Berechnungen ergänzt werden, liefert Kryo-Elektronenmikroskopie Bilder mit atomarer Auflösung.
Rätselhafte Filamente
Schon 2016 hatten Mitglieder aus Müllers Arbeitsgruppe beobachtet, dass HDCR lange Fäden (Filamente) bildet – das tun nur sehr wenige Enzyme. Müller berichtet: „Dass diese fädige Struktur wichtig für das Funktionieren des Enzyms war, konnten wir schon erkennen, als wir stattdessen die HDCR von genetisch minimal veränderten Bakterien untersuchten; deren manipulierte HDCR, die keine Filamente bildete, wies folglich eine stark verringerte Enzym-Aktivität auf.“
Welche Rolle die Filamente im Einzelnen spielen, sollte allerdings erst danach mithilfe der Kryo-Elektronenmikroskopie aufgeklärt werden; zusammen mit Wissenschaftlern vom „Zentrum für synthetische Mikrobiologie“ der Philipps-Universität Marburg haben Müller und sein Team festgestellt, dass das Rückgrat der Filamente jeweils aus den beiden kleinen Untereinheiten der HDCR besteht, die Eisen und Schwefel enthalten. „In den Fäden sind also Tausende von elektronen-leitenden Eisenatomen zusammengelagert; sie bilden damit eine Art Nanodraht“, berichtet Müller.
Die einzelnen „Momentaufnahmen“ ihrer experimentellen Ergebnisse setzen sich für die Forschenden um Müller damit zu einem „Film“ zusammen, der in acetogenen Bakterien wie beispielsweise T. kivui und A. woodii abläuft: „Das erste Modul spaltet den Wasserstoff (H2), dabei werden Elektronen freigesetzt und in den Nanodraht gepumpt“, beschreibt Müller. In dem Draht, der aus dem zweiten und dritten Modul besteht, würden die Elektronen dann zum nächstgelegenen CO2-Molekül transportiert und an dieses weitergegeben. Unter dem Einfluss des vierten Moduls entstehe daraus schließlich Ameisensäure (HCOOH).
„Die beiden Teilreaktionen, die an dem ersten und an dem vierten Modul ablaufen, werden also entkoppelt. Sie müssen nicht mehr gleichzeitig stattfinden, weil die Elektronen in dem Nanodraht gewissermaßen zwischengespeichert werden“, erläutert Müller. Das entspreche gerade der Situation, die acetogene Bakterien in den Natur vorfänden: Wenn sie auf eine Blase mit Wasserstoff träfen, könnten sie diesen „verdauen“ und die freigesetzten Elektronen so lange in dem Faden zwischenspeichern, bis ein CO2-Molekül verfügbar sei – genau das sei aber nicht ständig der Fall, sagt Müller; der Draht stelle also einen ökologischen Vorteil dar, weil die Bakterien mit seiner Hilfe ihre Stoffwechselprozesse (H2-Spaltung, Ameisensäurebildung) an die herrschenden Umweltbedingungen anpassen könnten.
Bündel von Enzym-Fäden
Zusammen mit Zellstruktur-Biologen aus Basel habe sein Team außerdem herausgefunden, sagt Müller, dass Hunderte der Filamente umeinander gewunden sind und eine ringförmige Struktur bilden, die in der Membran der Bakterienzellen verankert ist. „Die Bildung der Filamente und darüber hinaus ihre Bündelung erhöhen ihre Konzentration in der Bakterienzelle ganz beträchtlich“, erläutert er, „damit sind die Bakterien noch besser an geringe oder schwankende Wasserstoffkonzentrationen in ihrer Umgebung angepasst.“
Weil sie inzwischen herausgefunden haben, wie die Bildung von Ameisensäure durch die HDCR abläuft (wenn auch noch nicht in allen Details), können die Wissenschaftlerinnen und Wissenschaftler um Volker Müller daran gehen, diesen Prozess zu optimieren. „Zum Beispiel, indem wir die HDCR-Module austauschen, so dass sich die Bakterien nicht mehr von Wasserstoff, sondern zum Beispiel von Kohlenmonoxid ernähren“, sagt er. „Oder indem wir versuchen, das HDCR stabiler zu machen – weniger empfindlich gegenüber Sauerstoff. Oder indem wir einen synthetischen Nanodraht herstellen, mit dem wir Kohlendioxid aus der Atmosphäre einfangen können.“ Mit dem Bioreaktor, den sein (ehemaliger) Doktorand entwickelt hat, ist das, wie gesagt, noch nicht möglich.
Stefanie Hense