Wenn Zellen in Stress geraten, so läuft ein komplexes und genau reguliertes Programm ab, um bleibende Schäden abzuwenden. Als schnelle Reaktion nach einem Stress-Signal wird beispielsweise die Herstellung von Proteinen (Proteinsynthese) heruntergefahren. Bislang war es kaum möglich, solche akuten Veränderungen in der Zelle zu messen. Wie in der aktuellen Onlineausgabe der renommierten Fachzeitschrift Molecular Cell berichtet, haben Forscher der Goethe-Universität nun eine Methode entwickelt, die dies ermöglicht.
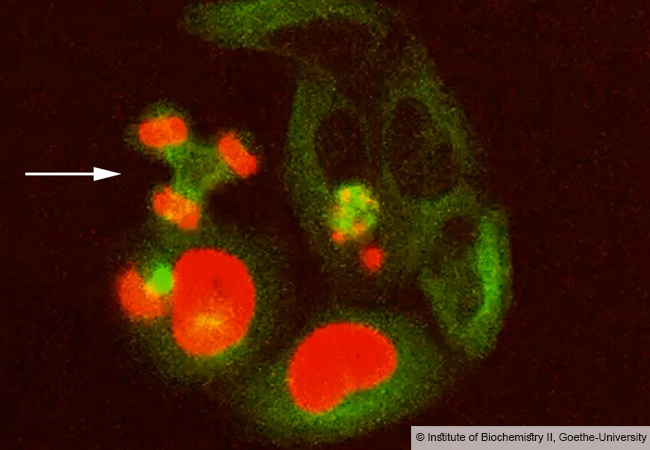
Das Team um den Biochemiker Dr. Christian Münch, der eine Emmy-Noether-Gruppe leitet, nutzte einen simplen, aber äußerst wirkungsvollen Kniff: Bei der Messung aller Proteine im Massenspektrometer wurde ein Kanal zugeschaltet, der speziell das Signal von neusynthetisierten Proteinen verstärkt und so deren Messung überhaupt ermöglicht. So gelang es erstmals, mit hochmodernen quantitativen massenspektrometrischen Technologien akute Veränderungen in der Proteinsynthese zu erfassen.
Die Idee dazu entwickelten die Forscher, weil sie verstehen wollten, wie spezifische Stress-Signale die Proteinsynthese beeinflussen. „Die Herausforderung bestand darin, dass die Menge an neu produzierten Proteinen innerhalb eines kleinen Zeitintervalls extrem niedrig ist, d.h. wir müssen mit unseren Messungen kleinste Veränderungen von wenigen Prozent für jedes einzelne Protein erfassen“, kommentiert Projektleiter Münch das Verfahren. Die neu entwickelte Analysemethode verschafft seinem Team nun detaillierten Einblick in die molekularen Ereignisse, die das Überleben der Zelle nach Stress sichern. Die Reaktion von Zellen auf Stress spielt z.B. bei der Entstehung von Krebs und neurodegenerativen Erkrankungen eine wichtige Rolle. Das Verständnis der zugrundeliegenden molekularen Prozesse öffnet damit auch die Tür für die Entwicklung neuer therapeutischer Strategien.
„Die von uns entwickelte Methode ermöglicht zeitlich hochauflösende Messungen, d.h. wir können die schnellen, innerhalb von Minuten ablaufenden Reaktionen der Zelle auf Stress messen, gleichzeitig benötigt sie wenig Material und ist zudem auch noch kostengünstig“, erklärt Münch. „Damit können wir nun Tausende von Proteinen in definierten Zeitabständen nach einer Behandlung simultan quantifizieren.“ Aufgrund der geringen benötigten Probenmengen seien auch Messungen in Gewebeproben von Patienten möglich, was die Zusammenarbeit mit klinischen Kollegen ermögliche. Für die Präsentation der ersten Daten, die mit der neuen Methode erzeugt wurden, wurde Doktorand Kevin Klann kürzlich bei einer Konferenz (EMBO) zur Proteostase in Portugal mit einem Posterpreis des FEBS-Journals ausgezeichnet.
Der junge Molekularbiologe konnte erstmals nachweisen, dass zwei der wichtigsten zellulären Signalwege, die durch sehr unterschiedliche Reize ausgelöst werden, letztendlich auf der Ebene der Proteinsynthese das gleiche bewirken. Diese Entdeckung bringt das Forschungsfeld einen entscheidenden Schritt nach vorn. Das Projekt wird vom Europäischen Research Council (ERC) als Teil des von Münch eingeworbenen Starting Grants mitoUPR gefördert, in dem er Mechanismen der Qualitätskontrolle für mitochondriale Proteine untersucht. Christian Münch wird darüber hinaus im Emmy-Noether-Programm der Deutschen Forschungsgemeinschaft (DFG) gefördert und ist Mitglied der Johanna Quandt Young Academy at Goethe.
Seit Dezember 2016 leitet er die Arbeitsgruppe „Protein Quality Control“ am Institut für Biochemie II im Fachbereich Medizin der Goethe-Universität, nachdem er zuvor in einem der führenden Proteomiklabors an der Harvard-Universität tätig war.