Ist es möglich, auf der Zellebene zuzusehen, wie sich Fischembryonen zu Forellen, Karpfen oder Lachsen entwickeln? Forschern der Goethe-Universität ist dies gelungen, indem sie eine spezielle Form der Fluoreszenzmikroskopie mit einer zweiten Mikroskopiertechnik kombiniert haben. Das neue hochauflösende Lichtmikroskop erlaubt faszinierende Einblicke ins Zellinnere.
Doch was ist das Neue dabei? Bereits mit der herkömmlichen konfokalen Fluoreszenzmikroskopie ließen sich Organismen sehr präzise und plastisch bei der Ausdifferenzierung ihrer Zellen beobachten. Wissenschaftler kennzeichnen Zellmoleküle mit fluoreszierenden Markern, die ein Lichtstrahl zum Leuchten bringt. Eine Kamera nimmt die dreidimensionale Verteilung der leuchtenden Moleküle, der Fluorophore, auf.
Ernst Stelzer, Professor am Institut für Zellbiologie und Neurowissenschaft und Forschungsleiter im Exzellenzcluster „Makromolekulare Komplexe“ der Goethe-Universität, hat mit seiner Arbeitsgruppe die Fluoreszenzmikroskopie entscheidend weiterentwickelt. Sein Lichtscheiben-Fluoreszenzmikroskop (LSFM) geht sehr schonend selbst mit so empfindlichen Proben wie Fischembryonen um. Ein großer Fortschritt, denn herkömmliche Verfahren zerstörten bisher durch die Energie der Photonen die Farbstoffe und die Zellen in sehr kurzer Zeit.
Bei der von Stelzer entwickelten Technik nehmen mikrometerdünne Lichtscheiben nur die Bereiche der Zelle in den Fokus, die die Wissenschaftler genauer betrachten wollen. Die Kamera nimmt Bilder der Probe aus verschiedenen Richtungen und Winkeln auf. Computer setzen die Einzelbilder zu dreidimensionalen Gesamtbildern und Filmen zusammen. „Da wir die Zellproben unter möglichst natürlichen Wachstumsbedingungen untersuchen, können wir sehr präzise Ergebnisse erzielen“, so Stelzer. Doch nicht nur statische Abbildungen von Zellen, sondern auch dynamische Veränderungen in der Umgebung oder von Genmutationen lassen sich im direkten Vergleich messen.
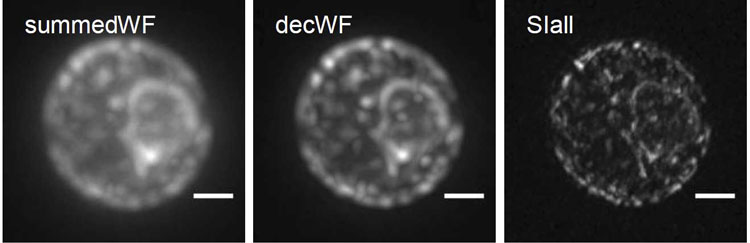
Bo-Jui Chang, Victor Perez Meza und Ernst Stelzer haben das Verfahren jetzt noch weiter verbessert: „Wir haben nun die Lichtscheiben-Fluoreszenzmikroskopie mit der kohärenten strukturierten Beleuchtungsmikroskopie (SIM) kombiniert. Das macht eine extrem hohe Auflösung möglich“, berichtet er. Die SIM ist eine Superauflösungstechnik, die mehrere Bilder erzeugt und sie miteinander kombiniert. Dadurch verbessert sich die Auflösung im physikalischen Sinn. Technisch geht man so vor, dass man eine fluoreszierende Probe mit einem ganz bestimmten Beleuchtungsmuster anregt. Die Methode ist auf Oberflächen beschränkt, hat aber große Vorteile. So ist sie beim Anregen der Fluoreszenz nicht zu intensiv, ermöglicht sehr schnelle Aufnahmen und kann mit allen fluoreszierenden Molekülen für die Hochauflösung eingesetzt werden.
„In dem neuen Mikroskop, das wir csiLSFM nennen, haben wir das Prinzip von SIM so weiter entwickelt, dass es nicht mehr auf Oberflächen beschränkt ist, sondern auch in ausgedehnten dreidimensionalen Objekten angewandt werden kann. Dazu lassen wir zwei gegenläufige Lichtblätter miteinander interferieren, und zwar unter einem Winkel von 180 Grad, so dass sie das kleinstmögliche Interferenzmuster bilden. Wir erreichen damit eine maximale Auflösung von unter 100 Nanometern, die.“, erklärt Ernst Stelzer. Das neue Instrument hat drei Objektivlinsen. Es arbeitet mit einer flexiblen Steuerung von Rotation, Frequenz und Phasenverschiebung der perfekt modulierten Lichtscheiben.
Bilder vom endoplasmatischen Retikulum, einem weit verzweigten Membrannetzwerk aus Röhren, Bläschen und Zisternen, in Hefen zeigen, dass die Forscher mit csiLSFM an physiologisch bedeutenden Objekten erfolgreich arbeiten können.
Publikation: Chang BJ, Perez Meza VD, Stelzer EHK (2017) csiLSFM combines light-sheet fluorescence microscopy and coherent structured illumination for a lateral resolution below 100 nm. Proc Natl Acad Sci U S A, 114(19):4869-4874. doi: 10.1073/pnas.1609278114 (2017 May 9). Epub 2017 Apr 24.
Quelle: Pressemitteilung vom 17. Mai 2017













