Zwei Forscher der Goethe-Universität Frankfurt suchen Schwächen im ausgefeilten Abwehrsystem von Bakterien. Das Ziel: neue Ansätze bei der Bekämpfung bakterieller Infektionen finden. Auch im Rahmen der Clusterinitiative SCALE werden die beiden daran arbeiten.
Transportproteine sind Membranproteine mit spezieller Aufgabe: Sie sorgen für den Stoffaustausch zwischen dem Zellinnern und dem extrazellulären Raum. Eine große Familie von Transportern nennt sich ABC-Transporter, ABC steht für ATP-binding cassettes. Charakteristisch für sie ist, dass sie das Energiespeichermolekül Adenosintriphosphat (ATP) aufspalten und so die Antriebskraft gewinnen, die für den aktiven Transport von Stoffen durch die Zellmembran nötig ist. Damit gehören diese Pumpen zu den primär aktiven Transportern.
Clemens Glaubitz vom Institut für Biophysikalische Chemie erforscht ABC-Proteine, die bei Bakterien den Stofftransport regeln. Und zwar bei Gram-negativen Bakterien, zu denen Escherichia coli, Klebsiella oder Acinetobacter baumannii gehören. Gram-negative Bakterien besitzen nicht nur eine Membran, die das Zellinnere umhüllt und schützt, die eigentliche Zellmembran also. Sondern noch eine zweite äußere Membran, die von der inneren durch das Periplasma getrennt wird. Beide Membranen unterscheiden sich in ihrem Aufbau voneinander: Während die innere aus einer symmetrischen Lipid-Doppelschicht besteht, ist die äußere asymmetrisch und mit komplexen Verbindungen bestückt. Diese bestehen aus Fettsäuren und Lipopolysacchariden (LPS), also Zuckermolekülen. „Die sind der wichtigste Baustein der äußeren Membran, weil sie dazu beitragen, die zelluläre Architektur der Bakterien aufrechtzuerhalten“, erklärt Glaubitz.
SCALE – Subcellular Architecture of Life
Zellen bestehen aus Milliarden von Molekülen, die von Einzelmolekülen über große Molekülkomplexe bis hin zu Organellen organisiert sind. Zwar sind die Funktionen vieler einzelner Moleküle bekannt, doch ist noch vielfach unklar, wie die Architektur im Innern einer Zelle entsteht, funktioniert und wie die Teile interagieren. Die Wissenschaftlerinnen und Wissenschaftler von SCALE wollen die Selbstorganisationsprinzipien der Zelle aufdecken und eine räumlich wie zeitlich hochaufgelöste Simulation der Zelle erstellen. So wollen sie besser verstehen, wie Zellen wirklich funktionieren und wie ihre verschiedenen »Maschinen« zusammenarbeiten. Die Deutsche Forschungsgemeinschaft hat am 2. Februar bekannt gegeben, dass SCALE auf Basis des Konzepts nun im August 2024 einen Vollantrag stellen darf, um sich auf eine Förderung als Exzellenzcluster ab 2026 zu bewerben.
https://scale-frankfurt.org
Jedoch muss das LPS erstmal die äußere Membran erreichen, sonst kann es seine stabilisierende Wirkung gar nicht entfalten. Genau diese fürs Bakterium lebenswichtige Aufgabe übernehmen ABC-Transporter: Sie bringen die Zuckermoleküle vom Zellinnern, dem Produktionsort, durch die Zellmembran und das Periplasma hindurch an ihren Bestimmungsort. Derzeit wird im Glaubitz Lab der ABC-Transporter MsbA und das an dieses Protein gekoppelte Transportsystem untersucht, das eine Art Brücke von der inneren zu äußeren Membran schlägt – die Zuckermoleküle müssen darauf nur noch in Richtung äußere Membran strömen. Glaubitz will anhand des Darmbakteriums Escherichia coli herausbekommen, wie der ganze Vorgang gesteuert wird.
Neue Angriffsziele für Antibiotika
Die experimentelle Methode dabei ist die Festkörper-NMR-Spektroskopie. Nuclear Magnetic Resonance-Spektroskopie setzt üblicherweise voraus, dass die zu untersuchenden Proben löslich sind. Die Technik lässt sich aber auch auf nichtlösliche Proben erweitern, dann spricht man von Festkörper-NMR-Spektroskopie. Was im Glaubitz Lab entdeckt wurde: MsbA und mit ihm verwandte ABC-Transporter in Gram-negativen Bakterien passen den Transport der Zuckermoleküle vermutlich an sich ändernde Umgebungsfaktoren an. Heißt konkret: Wenn es nötig ist, kann das LPS-Transportsystem seine Effizienz steigern. Glaubitz plant, MsbA später als Modell-Protein für alle anderen derartigen Systeme bei anderen Gram-negativen Bakterien zu benutzen. Zum Beispiel beim Bakterium Acetinobacter baumannii. Wohin die Grundlagenforschung führen könnte? LPS-transportierenden Proteine wie MsbA könnten in Zukunft neue Targets bei der Behandlung bakterieller Infektionen sein, also Angriffsziele für Antibiotika. „Vielleicht gelingt es uns eines Tages, diejenigen Proteine zu hemmen, die in den Transport von LPS involviert sind.“ Dann erreichen diese nicht mehr die äußere Membran – und der Stabilisator der Bakterienarchitektur fällt weg.
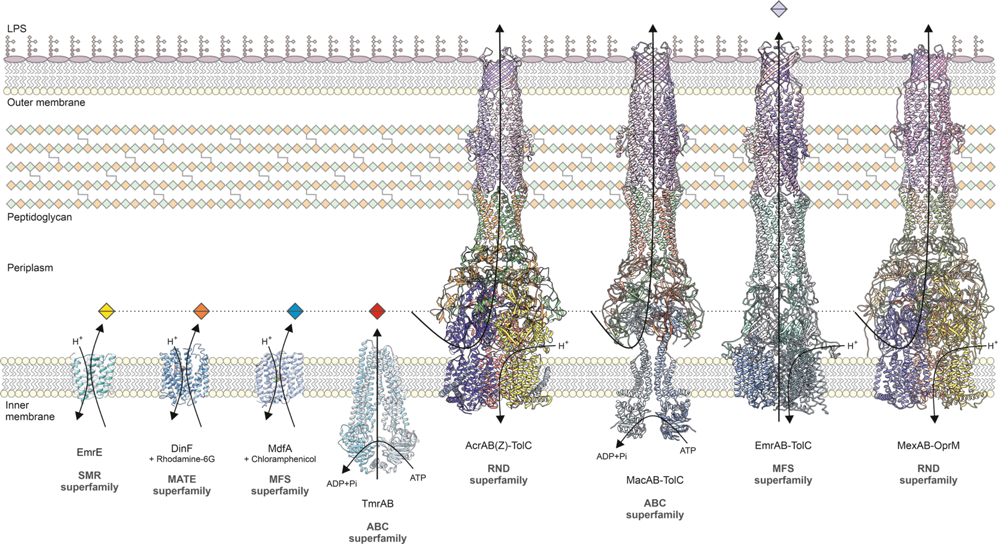
Den Zuckerpolymertransport von innen nach außen zu verhindern, wäre noch aus einem anderen Grund wichtig für die Bekämpfung von Krankheitserregern. Denn das LPS stellt auch eine erste äußere Barriere gegen Antibiotika dar. Der Grund: Die Zuckerpolymere sind hydrophil, also Wasser-liebend, Antibiotika dagegen hydrophob, Fett-liebend. Weswegen sie kaum durch die äußere Membran hindurchkommen. Schaffen sie es aber doch, treffen sie weiter drinnen gleich auf eine zweite Verteidigungslinie. Diese erforscht Klaas Martinus Pos vom Institut für Biochemie. Er hat die RND-Transporter-Familie im wissenschaftlichen Blick. RND steht für resistance nodulation cell division. Diese Transporter sind in die innere Zellmembran der Bakterien eingebettet und gehören zu den sekundär aktiven Transportern, da sie den elektrochemischen Gradienten von Ionen nutzen, um die für den aktiven Transport von Stoffen nötige Energie umzuwandeln.
Diese Pumpen sind so etwas wie Türsteher. Sie verhindern, dass Antibiotika-Moleküle durch die innere Zellmembran ins Zytoplasma diffundieren. Vorher werden die Eindringlinge gepackt und wieder in die Umgebung ausgeschleust. Dabei wenden die ABC-Transporter den Antiport-Mechanismus an, erklärt Pos: „Sie transportieren die Ionen in die eine Richtung, also ins Zellinnere – und den toxischen Stoff in die entgegengesetzte Richtung, also nach draußen.“ Escherichia coli und Klebsiella pneumoniae gehören zu den von Pos untersuchten Bakterien. Beide verlassen sich auf eine dreiteilige Efflux-Pumpe, die AcrAB-TolC genannt wird. Im Pos Lab wurde entdeckt, wie sie funktioniert. AcrB ist der eigentliche RND-Transporter und AcrA ein Adaptorprotein. Es befindet sich im Periplasma und verbindet den RND-Transporter mit der dritten Pumpen-Komponente, der Pore TolC in der äußeren Membran. Alle drei bilden einen flexibles langes Tunnelsystem, über welches Antibiotika ausgeschleust werden. „Diese dreiteilige Efflux-Pumpe ist enorm effizient. Sie erkennt fast alle bekannten Antibiotika und pumpt sie nach draußen.“ Man spricht auch von einer multiplen Antibiotika-Efflux-Pumpe. An ihr allein liegt es, dass bestimmte Bakterien gegen eine Vielzahl Antibiotika resistent, also multiresistent, sind.
Im Pos Lab konnte auch schon geklärt werden, wie der Antrieb der Efflux-Pumpe funktioniert. Sie bindet Protonen aus dem Periplasma und entlässt sie ins Zytoplasma. „Dabei kommt es im Membranteil der Pumpe zu elektrostatischen Veränderungen, die dafür sorgen, dass sich die Antibiotika-Moleküle im Tunnel-system ganz spezifisch in eine Richtung bewegen: nach außen.“ Der flexible Tunnelmechanismus ähnelt der einer peristaltischen Pumpe, wie sie auch unsere Speiseröhre hat. Damit könnten wir Menschen selbst im Kopfstand feste Nahrung zu uns nehmen – sie landet trotz entgegengestellter Schwerkraft im Magen. Die Efflux-Pumpe der Bakterien nutzt diesen Mechanismus, um zu verhindern, dass die Antibiotika während des Abtransports in die Zelle zurückrutschen.
Schnappschüsse von der Efflux-Pumpe
Um herauszufinden, wo und wie Antibiotika eingefangen und ausgeschleust werden, braucht es hochaufgelöste Strukturen, die im besten Fall einzelne Atome sichtbar machen. Im Pos Lab erstellt man mittels gezüchteter Kristalle Elektronendichtekarten und baut damit 3D-Strukturen der dreiteiligen Pumpen. Was auch mithilfe von Einzelpartikel-Kryo-Elektronenmikroskopie funktioniert. „Beide Methoden liefern uns Schnappschüsse, einzelne Bilder der Efflux-Pumpe bei der Arbeit. Diese können wir uns nacheinander anschauen. Das ist wie Daumenkino: Wir sehen förmlich, wie das Antibiotikum durch den Tunnel gepumpt wird.“
Zusammen mit der Arbeitsgruppe von Prof. Achilleas Frangakis und dem Institut Pasteur in Lille gelang es, mittels Schnappschüssen neuartige Inhibitoren zu entwickeln, Stoffe also, die die multiple Antibiotika-Efflux-Pumpe gezielt hemmen. „Damit könnte es möglich werden, bakterielle Infektionen mit schon vorhandenen Antibiotika, gegen die sich Bakterien resistent gezeigt haben, wieder effektiv zu bekämpfen.“ Dass die Hemmstoffe wirken, wurde kürzlich in einem Lungeninfektionsmodell an Mäusen, die mit Klebsiella pneumoniae infiziert waren, nachgewiesen. Zwei Forschende der Gruppen von Pos und Frangakis, Clara Börnsen und Reinke Müller, gewannen für ihre Arbeit an diesen Hemmstoffen im Dezember 2023 den Unibator Innovationspreis der Goethe-Universität Frankfurt. Das Konzept hieß „Antibiotika reloaded“.
Die Grundlagenforschung im Bereich der Resistenzmechanismen von Bakterien sind dringend nötig, so Pos. „Zurzeit werden global pro Jahr 1,3 Millionen Menschen durch multiresistente Erreger getötet. Falls wir heute nichts unternehmen, müssen wir im Jahr 2050 mit jährlich zehn Millionen Sterbefällen rechnen.“ Das wären mehr Tote durch multiresistente Erreger als zurzeit durch Krebserkrankungen
Autor: Andreas Lorenz-Meyer













