Mutationen im Protein p63 führen zu einer Reihe von Krankheits-Syndromen, aber keines ist so schwerwiegend wie das AEC-Syndrom. Forscher der Goethe-Universität und der Universität Neapel haben nun entdeckt, dass dieses Syndrom Krankheiten wie Alzheimer, Parkinson oder ALS ähnlicher ist als anderen p63-basierten Syndromen. Mit ihrer in der Fachzeitschrift „Proceedings of the National Academy of Sciences“ (PNAS) veröffentlichten Arbeit legen sie einen Grundstein zur Entwicklung neuer therapeutischer Ansätze.
Viele Krankheiten beruhen auf genetischen Anomalien, die zu Fehlfunktionen von Proteinen führen. Ein bekanntes und gut untersuchtes Beispiel ist der Tumorsuppressor p53, dessen Inaktivierung zu einem der ersten Schritte bei der Entstehung von Krebs gehört. Mutationen des verwandten Proteins p63 hingegen führen zu einer Gruppe von Syndromen, die durch Störungen in der embryonalen Entwicklung gekennzeichnet sind.
p63 fungiert als Transkriptionsfaktor in den Stammzellen der Oberhaut (Epidermis) und reguliert deren Entwicklung und Vermehrung. Mutationen in einem bestimmten Bereich des Proteins verursachen das lebensgefährliche Ankyloblepharon-Ektodermaldysplasie-Clefting Syndrom (AEC-Syndrom). Die Krankheit ist unter anderem dadurch charakterisiert, dass Kinder mit Lippen-Kiefer-Gaumenspalten zur Welt kommen und andauernde Verluste der Oberhaut (Erosionen) erleiden, vergleichbar mit starken Verbrennungen. Einzelne Symptome können operativ behoben oder gelindert werden. Ein Ansatz zur Behandlung des Ursprungs hingegen war bisher auf Grund des fehlenden Verständnisses über die mutierten p63 Moleküle unmöglich.
Die Mutationen, die das AEC-Syndrom verursachen, beschränken sich auf zwei Domänen von p63 und überlappen nicht mit denen der anderen p63-assoziierten Syndrome. Diese Domänen gelten als Plattformen für Protein-Protein-Interaktionen und daher nahm man bisher an, dass die Krankheit durch einen Verlust von Bindepartnern ausgelöst wird.
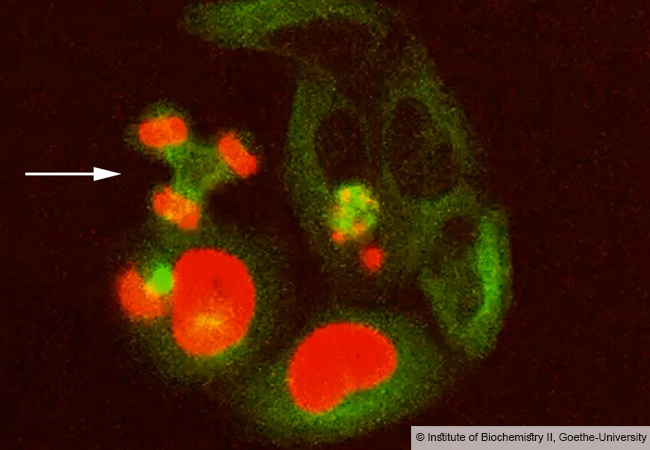
„Stattdessen konnten wird zeigen, dass die Mutationen zur Freilegung von hydrophoben Aminosäuresequenzen führen, die sich in der Zelle zusammenlagern und große, unstrukturierte Komplexe bilden“, erklärt Prof. Volker Dötsch vom Institut für Biophysikalische Chemie der Goethe-Universität. Auf diese Weise verliere das mutierte p63 seine Funktionen als Stammzellfaktor. Ähnliche Arten von Protein-Aggregaten sind auch die Ursache für andere Krankheiten wie Alzheimer, Parkinson oder ALS.
Um den neuartigen Mechanismus detailliert aufklären zu können, waren viele verschiedene biochemische, biophysikalische und zellbiologische Methoden sowie ein Maus-Modell des Syndroms notwendig. Ein Erfolg, der nur durch die enge und interdisziplinäre Zusammenarbeit mit der Gruppe von Prof. Caterina Missero von der Universität Neapel möglich war. Zusätzlich konnten die Wissenschaftler zeigen, dass p63 durch Auflösung der Aggregate seine Funktion wiedererlangt. Damit eröffnet sich ein neuer Weg zu einer erfolgversprechenden Behandlung der Ursachen des AEC-Syndroms.
[dt_call_to_action content_size=“small“ background=“plain“ line=“fancy“ style=“1″ animation=“fadeIn“]
Publikation: Claudia Russo, Christian Osterburg, Anna Sirico, Dario Antonini, Raffaele Ambrosio, Julia Maren Würz, Jörg Rinnenthal, Marco Ferniani, Sebastian Kehrloesser, Birgit Schäfer, Peter Güntert, Satrajit Sinha, Volker Dötsch und Caterina Missero: Protein aggregation of the p63 transcription factor underlies severe skin fragility in AEC syndrome, in PNAS early edition, www.pnas.org/cgi/doi/10.1073/pnas.1713773115
[/dt_call_to_action]
Quelle: Pressemitteilung vom 25. Januar 2017