Eine der größten Beeinträchtigungen der Lebensqualität nach überstandener Chemotherapie ist die Unfruchtbarkeit. Forschern der Goethe-Universität und der Universität Tor Vergata in Rom ist es nun gelungen, den Mechanismus für die Unfruchtbarkeit durch Chemotherapie bei Frauen zu entschlüsseln.
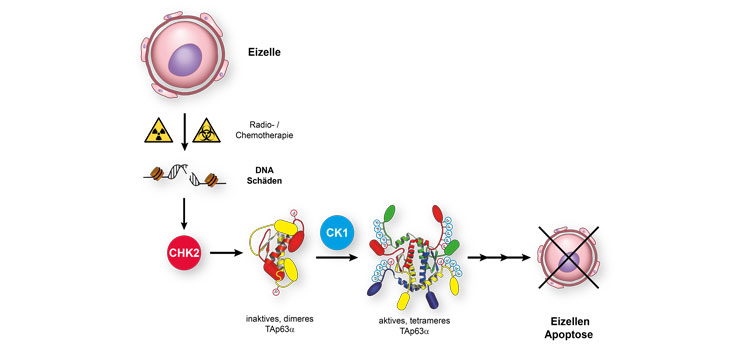
Der Wirkmechanismus vieler Chemotherapeutika beruht auf der Schädigung der DNA. Da Krebszellen sich häufiger teilen als die meisten gesunden Zellen, reagieren sie empfindlicher auf DNA-schädigende Substanzen. Eine Ausnahme bilden die weiblichen Eizellen. Um Gendefekte beim Nachwuchs möglichst gering zu halten, leiten sie bei DNA-Schädigungen den programmierten Zelltod ein. Diesen Vorgang, auch Apoptose genannt, steuert in Eizellen das Protein p63. Es liegt in einer Eizell-spezifischen Form in hoher Konzentration in den Eizellen vor, fungiert als Qualitätskontrollfaktor und spielt bei der Entstehung von Unfruchtbarkeit eine Schlüsselrolle.
Im Gegensatz zu Männern, die stetig neue Spermien produzieren, werden Frauen mit einer begrenzten Anzahl an Eizellen geboren. Ist dieser Pool erschöpft, beginnen die Wechseljahre. Gleiches gilt, wenn die Eizellen durch eine Chemotherapie dezimiert sind: Die Patientinnen kommen dann bereits viel früher in die Wechseljahre. Das ist nicht nur mit Unfruchtbarkeit verbunden, sondern auch mit anderen hormon-abhängigen Problemen wie Osteoporose.
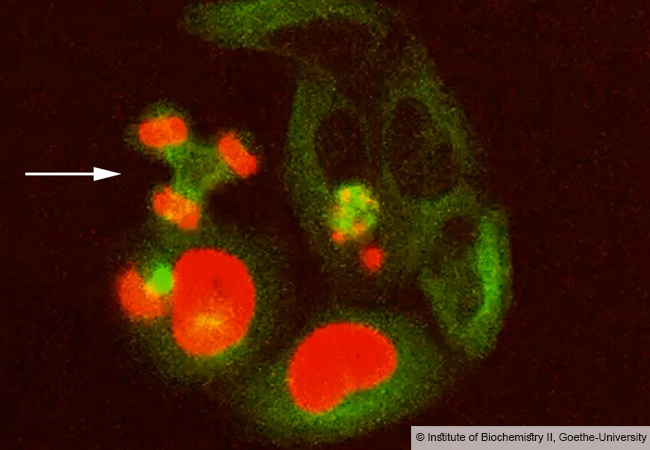
Die Wissenschaftler um Prof. Volker Dötsch vom Institut für Biophysikalische Chemie der Goethe-Universität konnten nun den Mechanismus aufklären, der zum vorzeitigen Absterben der Eizellen während einer Chemotherapie führt. p63 liegt in nicht-geschädigten Eizellen in einer inaktiven Konformation vor. DNA-Schäden durch systemische Radio- oder Chemotherapie bewirken, dass p63 mit Phosphatgruppen modifiziert und in die aktive Konformation überführt wird. Aktives p63 wiederum schaltet ein zelluläres Programm an, das den Zelltod der Eizelle einleitet. Wie in der Online-Ausgabe des Journals „Nature Structural and Molecular Biology“ berichtet, gelang es den Forschern nun, die molekularen Details der Aktivierung aufzudecken und alle am p63 Aktivierungsmechanismus beteiligten Enzyme zu identifizieren.
Dadurch eröffnet diese Studie neue Ansätze für eine mögliche Therapie. Wurden die identifizierten Schlüsselenzyme durch Inhibitoren blockiert, blieben die Eizellen von Mäusen unter der Einwirkung von Chemotherapeutika intakt. „Diese Erkenntnis bildet nun die Grundlage für die Entwicklung potenzieller Medikamente, die Eizellen während einer Chemotherapie auch im Menschen schützen und somit die vorzeitigte Einleitung der Wechseljahre unterdrücken sollen“, so Prof. Dötsch.
[dt_call_to_action content_size=“small“ background=“fancy“ line=“true“ animation=“fadeIn“]
Publikation: Tuppi M., Kehrloesser S., Coutandin D.W. et al. Oocyte DNA damage quality control requires consecutive interplay of CHK2 and CK1 to activate p63, in: Nature Structural and Molecular Biology. DOI: 10.1038/s41594-018-0035-7
[/dt_call_to_action]
Quelle: Pressemitteilung vom 27. Februar 2018