Die Deutsche Forschungsgemeinschaft (DFG) richtet zum 1. Januar 2019 den neuen Sonderforschungsbereich (SFB) 1361 „Regulation von DNA-Reparatur und Genomstabilität“ ein. Es ist der erste an dem alle drei Rhein-Main-Universitäten beteiligt sind. Die Sprecherschaft liegt bei der Gutenberg-Universität Mainz (JGU), unter Prof. Dr. Helle Ulrich. Beteiligt sind neben der Goethe-Universität und der Technischen Universität Darmstadt auch das Institut für Molekulare Biologie gGmbH Mainz (IMB) sowie die Ludwig-Maximilians-Universität München. Das Konsortium wird das Thema aus vielen verschiedenen Blickwinkeln analysieren.
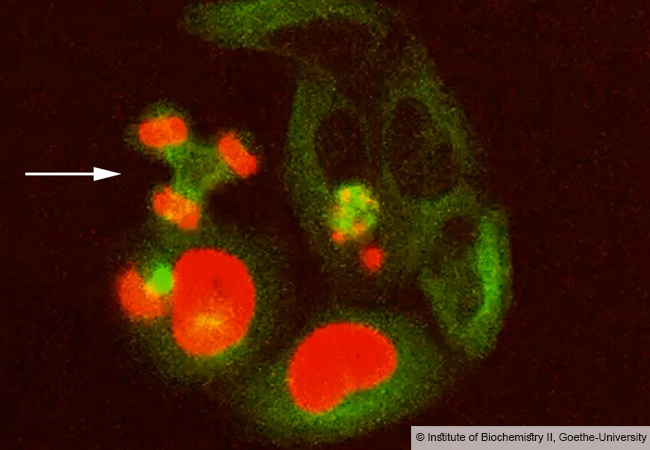
Von Seiten der Goethe-Universität ist der Molekularbiologe und Direktor des Instituts für Biochemie II, Prof. Ivan Dikic, beteiligt. Er leitet als Principal Investigator das Forschungsprojekt „Molecular mechanisms of replication stress response“. Das Projekt beschäftigt sich mit den Mechanismen, die während der Vervielfältigung der DNA (der Replikation) an besonders kritischen Stellen innerhalb der DNA für einen reibungslosen Ablauf sorgen. Zu diesen kritischen, schwierig zu replizierenden Stellen zählen DNA-Schäden, bei denen DNA mit Protein vernetzt wurde und die die Replikation zum Erliegen bringen können ebenso wie Telomere, die sich bei jeder Zellteilung verkürzen. Das Forschungsteam um Prof. Ivan Dikic am Institut für Biochemie II wird insbesondere versuchen, auf molekularer Ebene besser zu verstehen, wie Enzyme und Hilfsfaktoren funktionieren und reguliert werden, die die Replikation an solchen Stellen ermöglichen und damit die Zellen toleranter gegenüber Replikationsstress machen.
Ein weiteres wichtiges Ziel wird sein, den erst kürzlich entdeckten Mechanismus zur Lösung von DNA-Protein-Vernetzungen mit Hilfe des Enzyms SPARTAN im Detail zu charakterisieren. In Zellen, in denen diese verschiedenen Enzyme und Hilfsfaktoren nicht korrekt funktionieren, kommt es gehäuft zu chromosomalen Aberrationen, die die genetische Integrität der Zelle gefährden. Auch hier soll das Projekt neue Einblicke bringen, wie genau es zu solchen zum Beispiel bei Erkrankungen beobachteten schwerwiegenden Veränderungen im Erbgut kommt.
Das gesamte Thema, zu dem an den vier Standorten geforscht wird, ist hoch relevant für zahlreiche Erkrankungen, zum Beispiel für die Entstehung von Tumoren, die durch genomische Instabilität charakterisiert sind. Die DNA unserer Zellen wird kontinuierlich beschädigt und muss repariert werden, um die Integrität des Erbgutes und das korrekte Funktionieren von Zellen zu gewährleisten. Über die zugrundeliegenden DNA-Reparaturmechanismen ist bereits einiges bekannt, die größte Herausforderung liegt heutzutage darin, die Regulation des Systems zu verstehen und die Faktoren, die abhängig von dem jeweiligen Schadensereignis und dem Zustand der Zelle die Auswahl passender Reparaturmechanismen steuern.
Auch die Genauigkeit der Reparaturmechanismen ist in diesem Kontext von großem Interesse. In der Rhein-Main-Region kommt nun in einzigartiger Weise eine kritische Masse zusammen, um die Ursachen der genomischen Instabilität, die molekulare Details zur Erkennung von DNA-Schäden durch die zelluläre Maschinerie und DNA-Reparaturwege gemeinsam zu untersuchen. Die hierfür erforderliche Expertise in Strukturbiologie, organischer Chemie, Biochemie, Molekular- und Zellbiologie, genetischer Toxikologie und klinischer Wissenschaften ist im Konsortium vertreten. Innerhalb des Konsortiums stehen hochmoderne Methoden zur Mikroskopie, Proteom- und Genomanalyse, für die Schadenserkennung und -quantifizierung sowie für den Nachweis verschiedener DNA-Reparaturwege zur Verfügung.
[Autorin: Dr. Kerstin Koch]