T-Zellen sind maßgeschneiderte Werkzeuge unseres Immunsystems im Kampf gegen Infektionskrankheiten und Krebszellen. Auf ihrer Oberfläche tragen diese weißen Blutkörperchen einen Rezeptor für die Erkennung von Antigenen. Mit Hilfe von Kryo-Elektronenmikroskopie konnten Biochemiker und Strukturbiologen der Goethe-Universität Frankfurt in Kooperation mit der University of Oxford und dem Max-Planck-Institut für Biophysik erstmals den vollständigen T-Zell-Rezeptorkomplex mit gebundenem Antigen in atomarer Auflösung aufklären. So konnten sie das Verständnis eines fundamentalen Prozesses verbessern sowie die Basis für künftige Therapiemöglichkeiten schwerer Krankheiten legen.
Das Immunsystem der Wirbeltiere ist eine schlagkräftige Waffe gegen Krankheitserreger von außen und entartete Zellen des eigenen Körpers. Eine besondere Rolle spielen dabei die T-Zellen. Diese tragen auf ihrer Oberfläche einen Rezeptor für die Erkennung von Antigenen – kleinen Proteinbruchstücken von Bakterien, Viren und infizierten oder entarteten Körperzellen –, die ihnen von spezialisierten Immunkomplexen präsentiert werden. Der T-Zell-Rezeptor ist damit wesentlich für die Unterscheidung zwischen „Selbst“ und „Fremd“ verantwortlich. Nach der Bindung eines passenden Antigens an den Rezeptor wird im Inneren der T-Zelle ein Signalweg angeschaltet, der die T-Zelle für ihre jeweilige Aufgabe „bewaffnet“. Wie dieser Signalweg aktiviert wird, blieb bisher jedoch rätselhaft – und das, obwohl der T-Zell-Rezeptor zu den am besten untersuchten Rezeptor-Proteinkomplexen gehört.
Viele Oberflächenrezeptoren leiten Signale ins Innere von Zellen weiter, indem sie nach der Bindung ihres Liganden ihre räumliche Struktur verändern. Auch für den T-Zell-Rezeptor wurde dieser Mechanismus bislang vermutet. Wissenschaftler:innen um Lukas Sušac, Christoph Thomas und Robert Tampé vom Institut für Biochemie der Goethe-Universität ist es nun in Zusammenarbeit mit Simon Davis von der University of Oxford und Gerhard Hummer vom Max-Planck-Institut für Biophysik erstmals gelungen, die Struktur eines Membran-gebundenen T-Zell-Rezeptorkomplexes mit gebundenem Antigen sichtbar zu machen. Ein Vergleich der über Kryo-Elektronenmikroskopie gewonnenen Struktur mit der eines Rezeptors ohne gebundenes Antigen liefert erste Hinweise auf den Aktivierungsmechanismus.
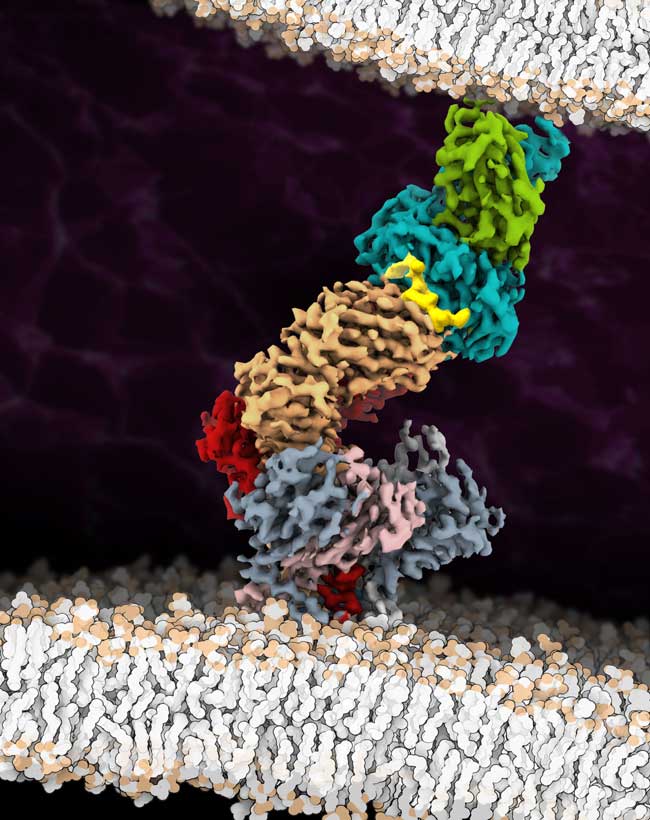
Für die Strukturanalyse wählten die Forscher:innen einen Rezeptor aus, der in der Immuntherapie zur Behandlung von Melanomen eingesetzt wird und dafür in mehreren Schritten so optimiert worden war, dass er sein Antigen möglichst bereitwillig bindet. Eine besondere Herausforderung bestand darin, den gesamten Antigen-Rezeptorkomplex aus elf verschiedenen Untereinheiten aus der Zellmembran zu isolieren. „Bis vor kurzem hätte niemand gedacht, dass es überhaupt möglich ist, so einen großen Membran-Proteinkomplex stabil aus der Membran herauszulösen“, sagt Tampé.
Nachdem dies gelungen war, nutzten die Forscher:innen einen Trick, um aus dem Versuchsansatz die Rezeptoren herauszufischen, die den Löseprozess überstanden hatten und noch funktionierten: Aufgrund der starken und selektiven Wechselwirkung zwischen Rezeptorkomplex und Antigen konnten sie einen der medizinisch relevantesten Immunrezeptorkomplexe „angeln“. Die anschließenden Aufnahmen mit dem Kryo-Elektronenmikroskop lieferten bahnbrechende Erkenntnisse über die Arbeitsweise des T-Zell-Rezeptors, wie Tampé zusammenfasst: „Anhand unserer Strukturanalyse konnten wir zeigen, wie der T-Zell-Rezeptor Antigene erkennt und Hypothesen aufstellen, wie die Signalweiterleitung nach Antigenbindung in Gang gesetzt wird.“ Die große Überraschung ist demnach, dass nach der Antigenbindung offensichtlich keine nennenswerte Änderung der räumlichen Struktur des Rezeptors erfolgt, denn diese war mit und ohne Antigen praktisch gleich.
Bleibt noch die Frage, wie die Antigenbindung stattdessen zur Aktivierung der T-Zelle führen könnte. Bekannt ist, dass sich nach der Antigenbindung der Ko-Rezeptor CD8 an den T-Zell-Rezeptor anlagert und die Übertragung von Phosphatgruppen auf dessen intrazellulären Teil stimuliert. Die Forscher:innen vermuten, dass sich hierdurch Strukturen bilden, zu denen Phosphatgruppen abspaltende Enzyme (Phosphatasen) keinen Zugang mehr haben. Fehlen diese Phosphatasen, verbleiben die Phosphatgruppen stabil am T-Zell-Rezeptor und können den nächsten Schritt der Signalkaskade auslösen. „Unsere Struktur ist eine Blaupause für zukünftige Studien zur T-Zell-Aktivierung“, ist Tampé überzeugt. „Außerdem liefert sie wichtige Impulse, um den T-Zell-Rezeptor therapeutisch nutzbar zu machen für die Behandlung von Infektionen, Krebs und Autoimmunerkrankungen.“
Publikation: Lukas Sušac, Mai T. Vuong, Christoph Thomas, Sören von Bülow, Caitlin O’Brien-Ball, Ana Mafalda Santos, Ricardo A. Fernandes, Gerhard Hummer, Robert Tampé, Simon J. Davis: Structure of a fully assembled tumor-specific T-cell receptor ligated by pMHC. Cell (2022) 185, Aug 18 https://doi.org/10.1016/j.cell.2022.07.010