So wie wir aus der Informationsflut in sozialen Medien das für uns Wichtige herausfiltern, arbeiten auch Körperzellen. Im ständigen Kampf gegen Parasiten, Viren oder Krebs selektieren sie Informationen für das Immunsystem. Das geschieht durch eine hochkomplexe molekulare Maschinerie, deren Arbeitsweise Biochemiker der Goethe-Universität und des Max-Planck-Instituts für Biophysik zusammen mit Forschern der Universität Halle aufgeklärt haben.
Status-Updates aus dem Inneren der Zelle erhält das Immunsystem an deren Oberfläche. Dort präsentieren bestimmte Proteine, sogenannte MHC I-Moleküle, die Information in Form kleiner Proteinbruchstücke. Krebszellen oder von Viren infizierte Zellen werden so im Idealfall schnell erkannt und eliminiert. Viren und Tumore können das Immunsystem aber auch austricksen. Außerdem kann eine missverständliche Nachricht zu Autoimmunerkrankungen oder chronischen Entzündungen führen.
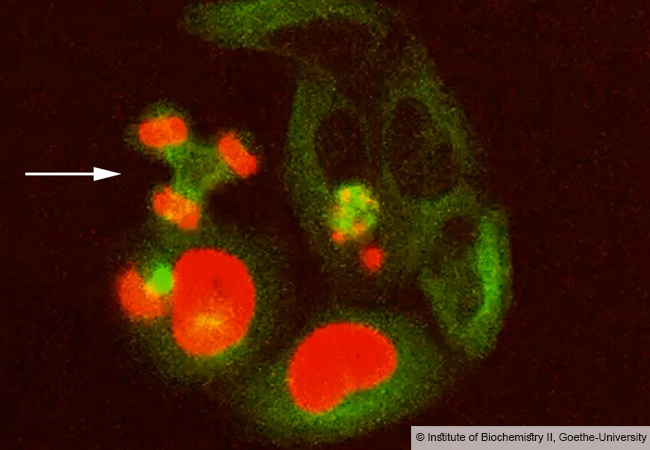
Deshalb ist es besonders wichtig zu verstehen, wie die hochkomplexe molekulare Maschine im Zellinneren die relevanten Proteinbruchstücke selektiert und das Beladen der MHC I-Moleküle koordiniert. In der aktuellen Ausgabe der renommierten Fachzeitschrift Nature geben nun die Forscher aus Frankfurt und Halle erstmals Einblicke in die Arbeitsweise und die molekulare Architektur des sogenannten MHC I-Peptidbeladungskomplexes.
„Um diesen äußerst fragilen Komplex für Strukturanalysen aufzubereiten, mussten wir alle Register der Biochemie ziehen“, erklärt Dr. Simon Trowitzsch vom Institut für Biochemie der Goethe-Universität. „So entwickelten wir zunächst einen viralen, molekularen Köder, um den MHC I-Peptidbeladungskomplex aus dem endoplasmatischen Retikulum isolieren zu können.“
„Dank der bahnbrechenden Verbesserungen in der Kryo-Elektronenmikroskopie, die kürzlich mit dem Nobelpreis ausgezeichnet wurde, konnten wir den MHC I-Peptidbeladungskomplex unmittelbar betrachten und dessen genaue molekulare Struktur bestimmen. Sie ist ungefähr hunderttausend Mal kleiner als ein Stecknadelkopf“, berichtet Dr. Arne Möller vom Max-Planck-Institut für Biophysik.
Aus der erhaltenen Struktur lässt sich ableiten, wie die Zelle es schafft, für das Immunsystem relevante Informationen zu generieren. Hierfür müssen Transportproteine in der Membran, Faltungsenzyme und MHC I-Moleküle präzise in einem Komplex zusammenarbeiten.
„Die Arbeit zeigt, wie der MHC I-Peptidbeladungskomplex nur solche Informationsfragmente herausfiltert, die auch von Effektor-Zellen des Immunsystems gelesen werden können. Diese Arbeit löst ein jahrzehntealtes Puzzle und erlaubt uns nun, den Prozess der Antigen-Selektion präziser zu beschreiben und Immuntherapien weiter zu verbessern,“ schlussfolgert Prof. Robert Tampé vom Institut für Biochemie.
Publikation: Andreas Blees, Dovilė Janulienė, Tommy Hofmann, Nicole Koller, Carla Schmidt, Simon Trowitzsch, Arne Moeller & Robert Tampé: Structure of the human MHC-I peptide-loading complex, NATURE (Nov 6, 2017, First Release) doi:10.1038/nature24627