Bakterien im Darm verpacken verschiedenste ihrer Biomoleküle in kleine Kapseln. Diese werden vom Blutkreislauf in verschiedene Organe des Körpers transportiert und sogar von Nervenzellen des Gehirns aufgenommen und verarbeitet. Dies hat jetzt erstmals ein Team von Forscherinnen und Forschern der Goethe-Universität Frankfurt sowie der Friedrich-Alexander-Universität Erlangen-Nürnberg und der University of California in San Francisco gezeigt. Die neu etablierte Forschungsmethode wird helfen, den Einfluss von Darmbakterien auf Krankheiten besser zu verstehen und könnte die Entwicklung innovativer Verabreichungsformen von Medikamenten oder Impfstoffen fördern.
Im Menschen sind Bakterien in der Überzahl: Schätzungen zufolge kommen auf jede menschliche Zelle 1,3 Bakterienzellen. Entsprechend überlegen sind uns unsere Bakterien in ihrer genetischen Vielfalt. So haben alle Darmbakterien zusammen – das Mikrobiom des Darms – 150mal so viele Gene wie der Mensch. Die Stoffwechselprodukte der Darmbakterien wirken vielfältig auf unseren Körper: Sie trainieren etwa unsere Immunzellen und tragen zu deren Reifung bei, sie steuern Stoffwechselprozesse im Körper und wie häufig sich Zellen der Darmschleimhaut erneuern. Änderungen in der Zusammensetzung des Mikrobioms tragen höchstwahrscheinlich zum Entstehen und Krankheitsverlauf etwa von neurologischen- oder Krebserkrankungen bei.
Auf die Zellen der Darmschleimhaut wirken die bakteriellen Stoffwechselprodukte über den direkten Kontakt. Wie solche Bakterienstoffe jedoch in entfernte Organe wie Leber, Niere oder das Gehirn gelangen, war bislang nicht geklärt. Als Transportmittel wurden kleine Kapseln (Membranbläschen oder Vesikel) vermutet, die von Bakterien während ihres normalen Wachstums oder als Reaktion auf Stress in die Umgebung abgegeben werden und die mit bakteriellen Enzymen, Proteinen oder auch RNA-Erbmolekülen gefüllt sind.
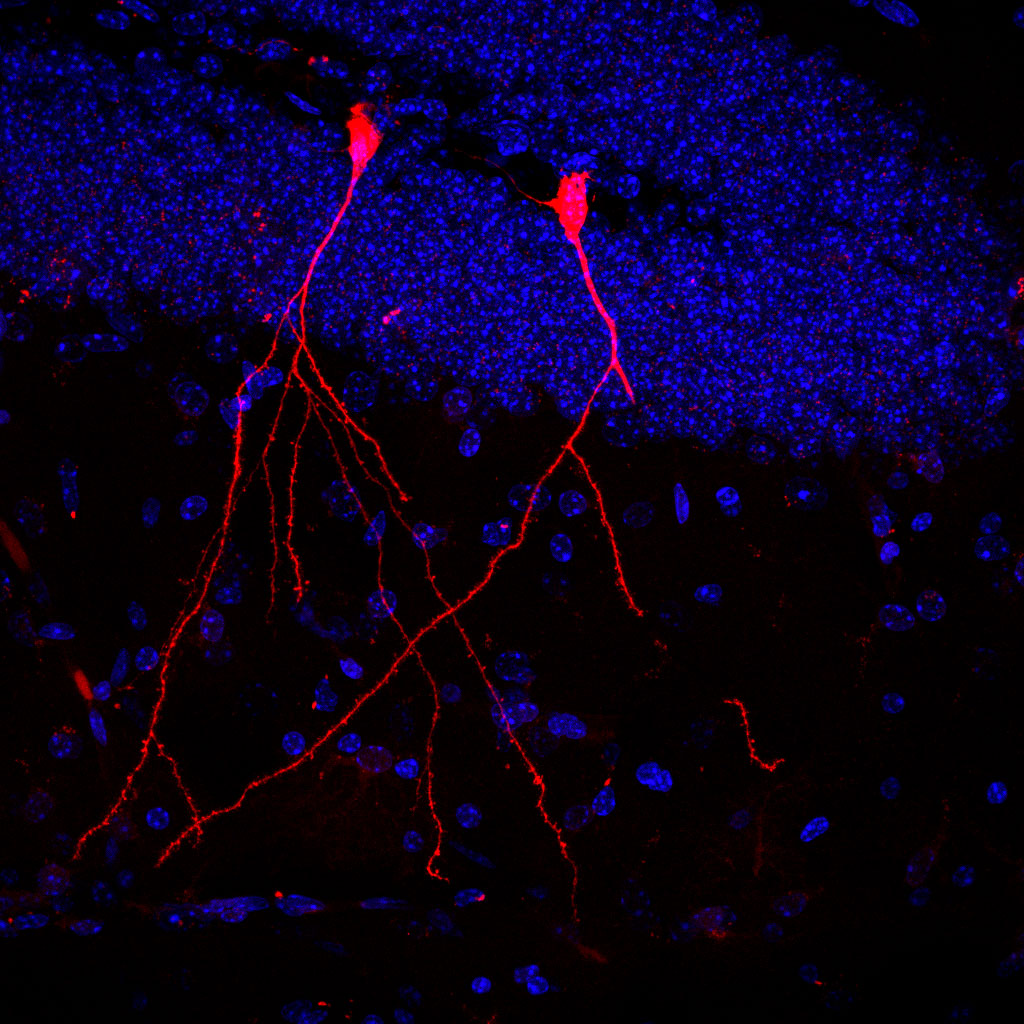
Ein internationales Wissenschaftsteam um Dr. Stefan Momma vom Neuroscience Center der Goethe-Universität Frankfurt, Prof. Claudia Günther von der Universität Erlangen-Nürnberg und Prof. Robert Raffai von der University of California hat jetzt an Mäusen untersucht, wie Bakterien ihre Stoffwechselprodukte in solchen Vesikeln verteilen. Dazu besiedelten die Forscher:innen den Darm von Mäusen mit E.-coli-Bakterien, die eine bestimmte Genschere produzierten (Cre) und diese über Vesikel in die Umgebung abgaben. Die Mäuse besaßen in Körperzellen ein Gen für ein rotes Leuchtprotein, das durch die Genschere Cre aktiviert werden konnte (Cre/LoxP-System).
Das Ergebnis: In der anschließenden Untersuchung des Mausgewebes waren die bakteriellen Stoffe von einzelnen Zellen des Darms, der Leber, der Milz, des Herzen und der Nieren sowie von Immunzellen aufgenommen worden. Sogar einzelne Nervenzellen des Gehirns leuchteten rot. Stefan Momma: „Besonders beeindruckend ist, dass die Vesikel der Bakterien auch die Blut-Hirn-Schranke überwinden und auf diese Weise in das ansonsten sehr gut abgeschottete Gehirn gelangen können. Und dass die bioaktiven Bakterienstoffe sogar von Stammzellen der Darmschleimhaut aufgenommen wurden zeigt uns, dass Darmbakterien womöglich sogar dauerhaft die Eigenschaften der Darmschleimhaut verändern können.“
Die Fluoreszenzbilder weisen darauf hin, so Momma, dass die Vesikel wahrscheinlich über den Blutstrom im Körper verteilt würden. „Die weitere Erforschung dieser Kommunikationswege vom Reich der Bakterien ins Reich der Säugetiere wird nicht nur unser Verständnis von Leiden wie Autoimmunerkrankungen oder Krebs verbessern, bei dem das Mikrobiom ganz offensichtlich eine wichtige Rolle spielt. Solchen Vesikel sind auch äußerst interessant als neue Methode, um Medikamente zu verabreichen, oder zur Entwicklung von Impfstoffen oder als Biomarker die auf eine pathologische Veränderung des Mikrobioms hinweisen.“
Publikation: Miriam Bittel,Patrick Reichert,Ilann Sarfati,Anja Dressel,Stefanie Leikam,Stefan Uderhardt,Iris Stolzer,Tuan Anh Phu,Martin Ng,Ngan K. Vu,Stefan Tenzer,Ute Distler,Stefan Wirtz,Veit Rothhammer,Markus F. Neurath,Robert L. Raffai,Claudia Günther, Stefan Momma: Visualizing transfer of microbial biomolecules by outer membrane vesicles in microbe-host-communication in vivo. J Extracell Vesicles 2021 Oct;10(12):e12159 https://onlinelibrary.wiley.com/doi/10.1002/jev2.12159?af=R