Ein neu entdeckter Ubiquitinierungs-Mechanismus erklärt pathogene Effekte von Bakterien. Ivan Dikic und seine Gruppe vermuten, dass dieser auch an vielen anderen biologischen Prozessen beteiligt ist.
Die Markierung mit dem kleinen Molekül Ubiquitin galt lange als „Todeskuss“, durch den nicht mehr benötigte Proteine in der Zelle entsorgt werden. Doch inzwischen weiß man, dass Ubiquitin noch viele weitere Aufgaben in der zellulären Signalverarbeitung erfüllt. Ein Forscherteam unter Leitung von Prof. Ivan Dikic, Direktor des Instituts für Biochemie II an der Goethe-Universität Frankfurt, hat nun einen neuartigen Mechanismus zur Ubiquitinierung aufgeklärt, mit dem Legionellen die Steuerung ihrer Wirtszellen übernehmen können.
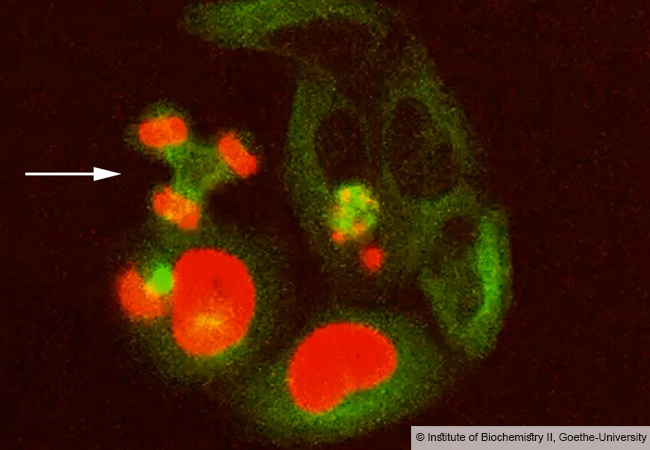
Nach der bisher gängigen Lehrmeinung erfordert die Anheftung von Ubiquitin an andere Proteine die konzertierte Aktion von drei Enzymen. Im April dieses Jahres beschrieben amerikanische Forscher erstmals eine Form der Ubiquitinierung, an der nur ein einziges Enzym aus Legionellen beteiligt ist. Das Team von Ivan Dikic hat nun gemeinsam mit der Gruppe von Ivan Matic (Max-Planck-Institut für Biologie des Alterns, Köln) den zugrundeliegenden molekularen Mechanismus aufgeklärt.

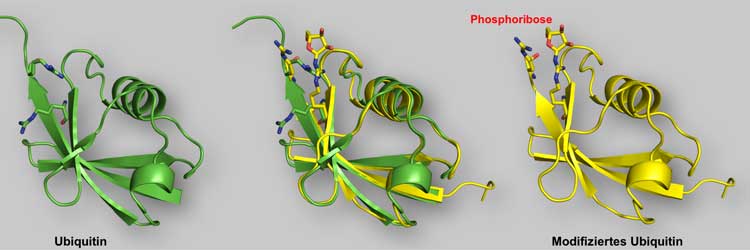
Verblüffend ist die bisher unbekannte Art der chemischen Verknüpfung von Ubiquitin mit Proteinen, die das Enzym aus den Legionellen herstellt. Für die Fachwelt ist das eine bahnbrechende Entdeckung. Dr. Sagar Bhogaraju, Wissenschaftler im Labor von Dikic, kommentiert: „Spannend ist nun vor allem die Frage, ob diese neuartige Ubiquitinierung auch unabhängig von bakteriellen Infektionen in menschlichen Zellen vorkommt und ob es ähnliche, bislang unentdeckte Enzyme beim Menschen gibt, die womöglich weitreichenden Einfluss auf zelluläre Prozesse haben.“
Bei der detaillierten Untersuchung des neuen Mechanismus wurden die Forscher erneut überrascht: Das Legionellen-Enzym katalysiert nicht nur die Ubiquitinierung zellulärer Proteine, es verändert außerdem alle weiteren vorhandenen Ubiquitin-Moleküle. Bei Infektionen mit Legionellen spielt diese modifizierte Form von Ubiquitin vermutlich eine wichtige Rolle, da sie das klassische Ubiquitin-System weitgehend hemmt.
Neben der „Abfallwirtschaft“ funktionieren dann auch weitere wichtige Prozesse in der Zelle nicht mehr, was für das Bakterium von entscheidendem Vorteil sein kann. So konnte das Team von Ivan Dikic zeigen, dass das modifizierte Ubiquitin die Entsorgung von Mitochondrien (Mitophagie) ebenso lahmlegt wie die Weiterleitung von Entzündungssignalen und den Abbau von Proteinen. Auf diese Weise könnten Legionellen fundamental in zelluläre Prozesse ihres Wirts eingreifen.
„Wir gehen davon aus, dass Legionellen nicht die einzigen Bakterien sind, die sich diesen Mechanismus zunutze machen. Hier könnten sich neue Strategien für die Entwicklung antibakterieller Agenzien ergeben, die komplementär zu konventionellen Antibiotika wirken und die zellulären Schäden durch bakterielle Enzyme begrenzen“, erklärt Dikic die medizinische Bedeutung der Entdeckung.

Ivan Dikic hat mit seiner Forschung am Institut für Biochemie II und am Buchmann Institut für Molekulare Lebenswissenschaften an der Goethe-Universität bereits in der Vergangenheit maßgeblich zu einem Paradigmenwechsel in der Ubiquitinforschung beigetragen. Er verfolgte schon früh die Hypothese, dass Ubiquitin-Signale von spezialisierten Bereichen in anderen Proteinen erkannt und übersetzt werden. Er konnte Ubiquitin-bindende Bereiche in über 200 Proteinen identifizieren und deren Rolle in normalen physiologischen Prozessen und bei der Entstehung von Erkrankungen wie Krebs, ALS und Parkinson belegen.
[dt_call_to_action content_size=“small“ background=“fancy“ line=“true“ animation=“fadeIn“]
Publikation
Bhogaraju S, Kalayil S, Liu Y, Bonn F, Colby T, Matic I, Dikic I. Phosphoribosylation of ubiquitin promotes serine ubiquitination and impairs conventional ubiquitination. Cell. 2016 Dec;167(6). DOI 10.1016/j.cell.2016.11.019
[/dt_call_to_action]
Quelle: Pressemitteilung der Goethe-Universität vom 29. November 2016