Krebs entsteht durch fehlerhafte DNA – so die aktuelle Lehrmeinung. Aber können auch fehlerhafte Abschriften der DNA in Form des Botenmoleküls RNA die Ursache sein? Für diese überraschende These gibt es inzwischen einige Anhaltspunkte. Um sie zu überprüfen, erhält Prof. Rolf Marschalek vom Institut für Pharmazeutische Biologie der Goethe-Universität ein mit 1,25 Millionen ausgestattetes Reinhart Koselleck-Projekt. Damit fördert die Deutsche Forschungsgemeinschaft besonders innovative und im positiven Sinne risikobehaftete Forschung.
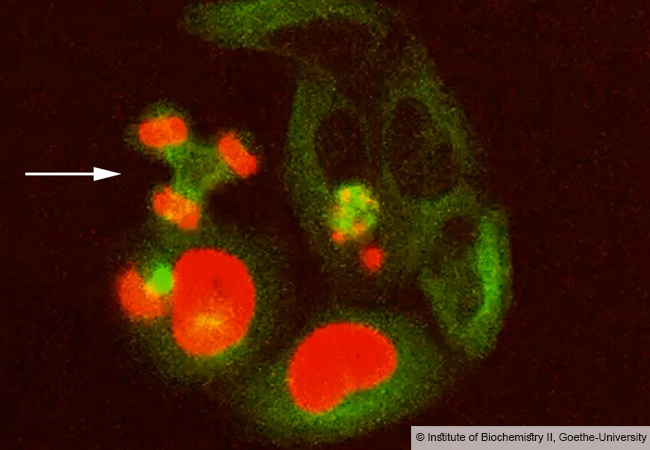
Marschalek erforscht seit vielen Jahren Gen-Mutationen, die verschiedene Formen der Leukämie verursachen. Besonders häufig kommt eine als Gentranslokation bezeichnete Mutation vor. Sie entsteht, wenn gleichzeitig an zwei verschiedenen Chromosomen Teile abbrechen und vom zelleigenen Reparaturprogramm vertauscht wieder angesetzt werden. Dadurch gelangen Gene nebeneinander, die normalerweise auf verschiedenen Chromosomen sitzen. Beim Abschreiben in die RNA werden sie irrtümlich so behandelt, als kodierten sie für ein einziges Protein. Diese sogenannten Fusionsproteine sind dann auch die kausale Krebsursache.
Auffällig ist aber, dass bestimmte Translokationen gehäuft vorkommen, obwohl rein statistisch eine viel größere Vielfalt an Doppelstrangbrüchen möglich wäre. Beispielsweise ist das Philadelphia-Chromosom, ein verkürztes Chromosom 22, und das dazu gehörige Protein BRC-ABL die häufigste Ursache der chronischen myeloischen Leukämie. Verwirrend ist zudem, dass BRC-ABL Transkripte auch bei völlig gesunden Menschen nachweisbar ist, die das Philadelphia-Chromosom gar nicht haben.
Eine mögliche Erklärung ist, dass die RNA nicht nur von der DNA abgeschrieben wird, sondern auch umgekehrt auf die DNA zurückwirken kann. Die meiste Zeit ist die DNA sicher und platzsparend in Chromatin verpackt und kann nicht abgeschrieben werden. Da könnte es für die Zelle ökonomischer sein, zur Reparatur von Doppelstrangbrüchen auf RNA Kopien zurückzugreifen, die sie vorsorglich in größerer Anzahl während der kurzen Phasen macht, in denen das Gen für die Abschrift zugänglich ist.
Tatsächlich kommen nicht für Proteine kodierende RNAs in der Zelle zuhauf vor. Und möglicherweise entstehen durch Fehler beim Abschreiben der DNA auch falsch zusammengestückelte RNAs, die dann in Fusionsproteine übersetzt werden. Marschalek hat auch eine Vermutung, wie die fehlerhaften RNAs entstehen: „In der Regel liegen Chromatinschlaufen mit aktiv transkribierbaren Genen auf der Außenseite der Chromosomenstrukturen. Dabei werden Chromatinschlaufen von verschiedenen Chromosomen gemeinsam in Transkriptionsfabriken transkribiert. Interessanterweise werden dort Gene miteinander transkribiert, die man in Krebszellen als Partnergene in chromosomalen Translokationen identifiziert hat.“ Warum das so ist, weiß man bisher nicht.
Seine Hypothese, dass RNA in der Zelle auch die Funktion hat, als Blaupause für die Reparatur von DNA-Fehlern zu dienen und dass dies manchmal ein teuflischer Pfad zum Krebs ist, kann Marschalek nun in den kommenden fünf Jahren dank der Förderung seines Koselleck-Projekts prüfen. Eine wichtige Rolle spielt dabei auch die CRISPR/Cas Technologie, mit der es viel einfacher geworden ist, Gene experimentell zu verändern.
Quelle: Pressemitteilung vom 1. August 2017