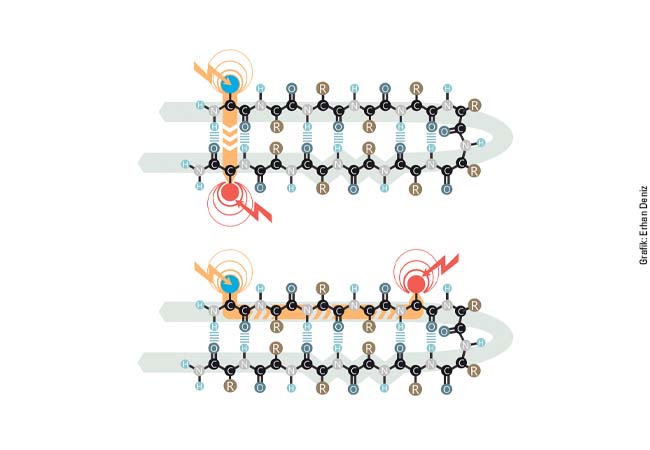
Mit Adrenalin, Dopamin, Histamin und Koffein verbindet man anregende Wirkungen. Alle Effekte dieser Botenstoffe werden über G-Protein-gekoppelte Rezeptoren (GPCR) vermittelt, die als Proteine in der Zellmembran einen gemeinsamen allgemeinen Aufbau besitzen und eine der wichtigsten Klassen von Arzneistoffzielen darstellen. Obwohl die Sequenz der Rezeptoren seit langem bekannt ist, herrschte über ihre Strukturen Unklarheit. Aufgrund der Flexibilität der GPCR in der Membran waren die exakten molekularen Interaktionen, die chemische Signale von außerhalb der Zelle in das Zellinnere weiterleiten, unbekannt – bis im Jahr 2007 die Gruppe um Prof. Raymond C. Stevens vom The Scripps Research Institut ein La Jolla (USA) erstmals eine Röntgenstruktur eines solchen Rezeptors publizierte.
Mit Adrenalin, Dopamin, Histamin und Koffein verbindet man anregende Wirkungen. Alle Effekte dieser Botenstoffe werden über G-Protein-gekoppelte Rezeptoren (GPCR) vermittelt, die als Proteine in der Zellmembran einen gemeinsamen allgemeinen Aufbau besitzen und eine der wichtigsten Klassen von Arzneistoffzielen darstellen. Obwohl die Sequenz der Rezeptoren seit langem bekannt ist, herrschte über ihre Strukturen Unklarheit. Aufgrund der Flexibilität der GPCR in der Membran waren die exakten molekularen Interaktionen, die chemische Signale von außerhalb der Zelle in das Zellinnere weiterleiten, unbekannt – bis im Jahr 2007 die Gruppe um Prof. Raymond C. Stevens vom The Scripps Research Institut ein La Jolla (USA) erstmals eine Röntgenstruktur eines solchen Rezeptors publizierte.
Um den kristallisierten 2-Adrenorezeptor strukturell in seiner dreidimensionalen Struktur im Komplex mit einem bindenden Antagonisten aufzulösen, waren mehr als 20 Jahre intensiver Vorarbeiten und zahlreiche Kooperationspartner notwendig. Stevens gelang es, in dieser Zeit eine Hochdurchsatz-Analyse zahlreicher verwandter Strukturen durchzuführen und damit eine starke und robuste universelle wissenschaftliche Plattform für solche Strukturanalysen zu etablieren. Nach der Auflösung des ersten humanen adrenergen GPCRs gelangen in kurzer Folge Koryphäe der Biochemie Raymond C. Stevens bekleidet die 21. Friedrich Merz-Stiftungsgastprofessur die Auflösung des Dopamin-D3-Rezeptors, des Adenosin-2A-Rezeptors sowie die des Chemokinrezeptors CXCR4.
Bei aller Ähnlichkeit der Proteinstrukturen zeigten sich deutliche Unterschiede bezüglich Bindung und Aktivierung. Obwohl zahlreiche Wissenschaftler vermuteten, dass stabile Liganden-GPCR-Komplexe wegen der Dynamik einer aktivierenden agonistischen Bindung nur mit hemmenden und damit strukturstabilisierenden Antagonisten möglich sei, bewies Stevens das Gegenteil. Durch den Vergleich der neu erhaltenen Strukturen ergeben sich heute ungeahnte Möglichkeiten für Arzneistoffentwicklungen in den Bereichen von der Parkinson-Erkrankung über Schmerz bis hin zu HIV-Infektionen. In Würdigung von Stevens herausragenden wissenschaftlichen Erfolgen hat ihn die Goethe-Universität 2011 zum 21. Friedrich Merz-Stiftungsgastprofessor ernannt. Im Rahmen dieser Würdigung wird Stevens zum einen eine Vorlesung für Studenten und Doktoranden halten, in der es um GPCR und Botolinum-Toxin gehen wird.
Zum anderen wird unter Stevens’ Beteiligung das hochrangige internationale Symposium „GPCR – An Update on Structure and Function 2011“ stattfinden, das ebenfalls von Merz Pharmaceuticals unterstützt wird. Die fruchtbare Kooperation zwischen der Hochschule und der pharmazeutischen Industrie wird an diesem Beispiel besonders deutlich: Auf der einen Seite ist es harte Grundlagenwissenschaft, die zur hochaufgelösten Kristallstruktur einer der größten und bedeutendsten Proteinfamilien geführt hat, andererseits stellt die Anwendung des erhaltenen Wissens eine immensen Fundus für neue Arzneistoffentwicklungen dar. Der translatorische Ansatz der Überführung des erhaltenen Wissens in angewandte Forschung wird auch von Raymond C. Stevens gelebt. Neben seiner Beteiligung an verschiedenen Arzneistoffentwicklungen ist er Gründer einiger biotechnologischer Firmen, bei der ein Wirkstoff bereits eine klinische Phase erreicht hat.
Raymond Stevens hat nach seinem Chemiestudium in nur 26 Monaten promoviert und ging 1988 in das Labor des Nobelpreisträgers W. N. Lipscomb, Jr. an der Harvard University, um dort Enzymstrukturen zu untersuchen. 1991 erhielt er eine Tenure track-Position an der University of California in Berkeley, wo er mit Prof. P. G. Schultz bereits an GPCR forschte. Der Wechsel an das Scripps Research Institute als Professor für Molekularbiologie und Chemie erlaubte ihm ab 1999 mit neuen Möglichkeiten verschiedene Netzwerke und Joint Center aufzubauen, die mit großem Finanzbedarf, großem Risiko und erst nach einer geraumen Zeit tatsächlich den Durchbruch in der Strukturbiologie dieser Proteinfamilie. Dass Stevens besonders ausdauernd und erfolgreich ist, zeigt er nicht nur, wenn er sich privat seinem sportlichen Hobby, dem Ultramarathon, widmet, sondern auch darin, dass in seinem Arbeitskreis inzwischen bereits weitere Proteine aufgelöst wurden.
Die Ähnlichkeiten und die Unterschiede in den 3DStrukturen geben Hinweise auf die Regulationsmechanismen der zellulären Kommunikation und auf neue Strukturveränderungen für Wirkstoffe. Raymond C. Stevens ist einer der Pioniere der modernen Röntgenstrukturanalyse in der Strukturbiologie und sicherlich ein herausragender Friedrich Merz-Stiftungsgastprofessor.
[Autor: Holger Stark]
Dieser Artikel ist in der Ausgabe 3.11 des UniReport erschienen.