Ob ein Wort als positiv oder negativ empfunden wird, hängt vom Zusammenhang ab: Ein künstliches Hüftgelenk kann sich als Segen für schmerzgeplagte Patientinnen und Patienten erweisen, ein künstlicher Aromastoff dient der Lebensmittelindustrie oft als billiger Zusatz, mit dem Produkte der Kundschaft schmackhaft gemacht werden sollen. Wenn Biophysik-Professor Jens Bredenbeck hingegen erläutert, wie und warum er künstliche Aminosäuren in seiner Forschung einsetzt, wird deutlich: Hier geht es um einen experimentellen Kunstgriff – der ihm kürzlich eine Veröffentlichung im renommierten Wissenschaftsjournal „Nature Communications“ eingebracht hat.
Mit seiner Arbeitsgruppe untersucht Bredenbeck an Proteinen den Transport von Schwingungsenergie: „Wir verwenden Laserlicht, um einen Teil der Atome, aus denen das Protein besteht, in Schwingungen zu versetzen“, erläutert Bredenbeck, „und wir beobachten, wie sich diese Schwingungen über das Protein ausbreiten.“ Während beispielsweise Schall – ebenfalls eine Schwingungsbewegung – sich in der Luft in alle Richtungen gleich gut ausbreite, sei das mit den Schwingungen in einem Proteinmolekül anders: In manche Richtungen klappe die Ausbreitung besonders gut, in andere schlechter.
„Ob bestimmte Atome mit den danebenliegenden Teilen des Proteinmoleküls mitschwingen, ob also Schwingungsenergie übertragen wird, können wir feststellen, indem wir zunächst einen orangefarbenen kurzen Laserpuls einstrahlen, der seine Energie auf eine bestimmte chemische Markierung im Protein überträgt“, fährt Bredenbeck fort, „von diesem Startpunkt aus wandert die Schwingungsenergie wie ein Beben durch das Molekül.“ In einiger Entfernung vom Startpunkt gebe es eine zweite chemische Markierung. „Wenn diese die Schwingungen spürt, verändert sie quasi ihre Farbe, und diese Änderung kann mithilfe eines zweiten, diesmal infraroten Laserpulses nachgewiesen werden“, sagt Bredenbeck. Entscheidend sei dabei die Wahl der beiden chemischen Markierungen, die so in der Natur nicht vorkommen: Während die Proteine aller natürlichen Organismen aus denselben 20 Bausteinen, sogenannten Aminosäuren, aufgebaut sind, enthalten die in der Gruppe Bredenbeck untersuchten Proteine zwei künstliche Aminosäuren. „Wir erweitern den Baukasten der Aminosäuren um zwei neue Bausteine und bauen damit neue Funktionen in Proteine ein: Der eine Baustein lässt sich mit orangefarbenem Laserlicht zum Schwingen bringen, der andere verändert seine Farbe, wenn er „geschüttelt“ wird.
Eindeutige Interpretation möglich
Dieses Vorgehen hat zwei Vorteile: Die Gruppe Bredenbeck arbeitet mit Laserlicht, dessen Farbe (= Wellenlänge) auf das jeweilige Protein abgestimmt sein muss. Um insbesondere ein Protein zu bestrahlen, das die künstlichen Aminosäuren enthält, können die Forschenden Laserlicht nehmen, das zwar in diesen Vibrationen erzeugt, das aber keine anderen Prozesse in Gang setzt: „Nur so lassen sich die Messergebnisse eindeutig interpretieren“, sagt Bredenbeck; außerdem könnten die künstlichen Aminosäuren mithilfe gentechnisch veränderter Bakterien genau an der jeweils gewünschten Stelle eingebaut werden. Indem Bredenbeck, seine Mitarbeiterinnen und Mitarbeiter jetzt beobachten, welche Stelle des Proteins wie auf die Bestrahlung mit Laserlicht reagiert, können sie es gewissermaßen abtasten und eine „Landkarte“ des Proteins erstellen, auf der die Reaktionen seiner einzelnen Abschnitte verzeichnet sind – das gibt Aufschluss darüber, auf welche Weise sich Schwingungen über das Protein ausbreiten.
Anders lasse sich nicht feststellen, welche Vorgänge in dem Protein abliefen, betont Bredenbeck, „wir wissen aus Simulationen, dass das Entscheidende bei der Ausbreitung von Schwingungen der Atome auf einer Zeitskala von Pikosekunden passiert, also Billionstel Sekunden“. Für Theoretiker sei es einfach, diese Situation in Simulationen abzubilden: „Wenige Pikosekunden lang an einzelnen Atomen eines Proteins zu wackeln – so etwas geben Sie einfach durch die Parameter des Computerprogramms vor.“ In der Realität des Labors gehe das aber nicht so ohne Weiteres: Für die Dauer von Pikosekunden an einzelnen Atomen eines Proteins zu wackeln, und die Ausbreitung der Schwingungsenergie zu messen, das schaffe nicht einmal das präziseste Rasterkraftmikroskop der Welt.
Hingegen sei es absolut „state of the art“, also aktueller Stand der Technik, eine Laserapparatur zu bauen, die ultrakurze Lichtpulse mit einer Dauer von nur einigen Zehntel oder gar Hundertstel Pikosekunden produziere. „Weil diese Laserpulse aufgrund ihrer Lichtwellenlänge nur an genau einer Stelle des Proteins Schwingungen erzeugen, nämlich am Ort der künstlichen Aminosäure, ist auch der jeweilige Ausgangspunkt der Schwingungen entsprechend genau definiert“, stellt Bredenbeck fest, „anders ausgedrückt: Für unsere Experimente haben wir jeweils die Schwingungsenergie an genau dieser Stelle des Proteins platziert und untersucht, wie sie in andere Teile des Proteins weitergegeben wird.
Wie kommt die Energie nach drüben?
Dabei untersuchten die Forschenden aus der Gruppe Bredenbeck eine Proteinstruktur, die von Kooperationspartnern an der TU Berlin hergestellt wurde. Ihre aus Kohlenstoff- und Stickstoff-Atomen bestehende Hauptlinie (das sogenannte Rückgrat des Proteins) ist wie eine Haarnadel geformt. Anhand ihrer Experimente konnten sie bestimmen, wie lange die Schwingungsenergie von einer Seite der Haarnadel auf die gegenüberliegende Seite braucht. „Zunächst stellten wir fest, je weiter der Startpunkt vom gebogenen Ende der Haarnadel entfernt war, desto länger dauerte es, bis die Schwingungsenergie auf dem anderen Arm der Haarnadel angekommen war.“ Das deute stark darauf hin, dass die Schwingungsenergie entlang des Rückgrats des Proteinmoleküls transferiert werde, erläutert Bredenbeck, also über das gebogene Ende.
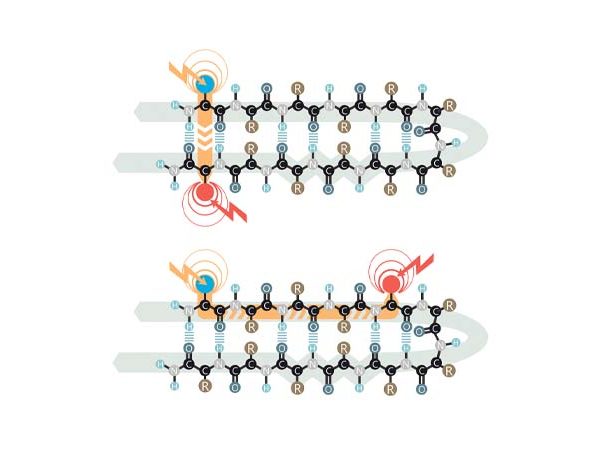
Denkbar sei jedoch auch ein zweiter Mechanismus, fährt Bredenbeck fort, bei dem die Weitergabe von Vibrationen grundsätzlich anders erfolge: Nicht entlang des Protein-Rückgrats, sondern indem „Seitenarme“, die von der Hauptachse ausgehen, einander so nahekommen, dass sie sich quasi berührten. „Dann kann die Schwingungsenergie gewissermaßen eine Abkürzung zur anderen Seite nehmen, und der Transfer erfolgt wie über eine Leitersprosse“, erläutert Bredenbeck.
„Und in der Tat konnten wir zeigen, dass der Transfer über diese Abkürzungen sehr effizient ist“, berichtet er. „Wir haben nämlich den Spezialfall untersucht, dass die Schwingungsenergie über eine Strecke transferiert wurde, deren Anfangs- und Endpunkt auf der gleichen Seite der Haarnadel lagen. Wenn Schwingungen sich nur über das Rückgrat des Proteins übertrügen, müsse dieser Transfer am schnellsten erfolgen. Aber genau das haben wir nicht gesehen. Im Gegenteil: Wenn die Schwingungsenergie einfach auf einer Seite der Haarnadel ein Stück weitertransportiert werden sollte, dauerte der Transport am längsten –, weil in diesem Fall keine Abkürzungsmöglichkeit über die ‚Leitersprossen’ zur Verfügung stand.“
Die beiden Transportmöglichkeiten „entlang der Protein-Rückgrats“ und „Abkürzung über Leitersprossen“ und die Messtechnik auf Basis der künstlichen Aminosäuren könnten nun helfen, das wichtige Phänomen der Allosterie besser zu verstehen. „Allosterie bedeutet, wenn sich an einer Stelle eines Proteins ein Molekül anlagert, dann ändern sich die Eigenschaften des Proteins an einer ganz anderen Stelle“, erläutert Bredenbeck. Simulationen kämen zu dem Schluss, dass zwischen diesen beiden Stellen dann oft auch besonders gut Schwingungsenergie übertragen werde, „und wir möchten diesen Energietransfer jetzt auch experimentell nachweisen“. Wenn nämlich zwischen zwei Orten effizient Schwingungsenergie übertragen werde, könnten prinzipiell auch Informationen über weite Strecken eines Proteins ausgetauscht werden, diese Orte also allosterisch gekoppelt sein.
Schwingungsenergie und die Evolution
„Schwingungsenergie fällt übrigens nicht nur an, wenn man Proteine mit Laserlicht bestrahlt, sondern auch, wenn Proteine zum Beispiel Reaktionen beschleunigen, indem sie als Katalysator wirken“, erläutert Bredenbeck. „Dann wird sie als thermische Energie frei, das heißt das Protein heizt sich auf. “ Interessant sei in diesem Zusammenhang auch, ob die Evolution die Kühlung von Reaktionszentren schon optimiert habe oder ob diese sich noch verbessern lasse.
Was passiert nun mit der Energie, die ursprünglich als Licht eingestrahlt, in Schwingungsenergie umgewandelt und von einer Stelle des Protein-Moleküls an eine andere transferiert wurde? „Wenn diese Energie erst mal als Schwingungsenergie vorliegt – vereinfacht gesagt: Wenn sich eine Gruppe von Atomen eines Protein-Moleküls hin- und herbewegt, dann sollte man diese Bewegungsenergie doch für irgendwas nutzen können“, sagt Bredenbeck.
Denkbar sei beispielweise, dass sie die Wirkung von Enzymen verstärke: „Bei dem Protein kann es sich zum Beispiel um ein Enzym handeln, das eine Stoffwechsel-Reaktion im Organismus ermöglicht“, erläutert Bredenbeck. Simulationen und indirekte Experimente hätten nahegelegt, dass Schwingungen wie die vom Licht hervorgerufenen solche Stoffwechsel-Reaktionen weiter beschleunigten. Zwar sei dieser Effekt vermutlich zu ineffizient, als dass er sich wirtschaftlich nutzen lasse, wendet Bredenbeck ein, „wir hoffen aber, durch solche Studien die Funktionsweise von Enzymen besser zu verstehen“.
Stefanie Hense
Dieser Beitrag ist in der Ausgabe 6/2021 (PDF) des UniReport erschienen.