Prof. Mauricio Montal, Professor of Biology an der University of California in San Diego, USA, ist der diesjährige Friedrich Merz-Stiftungsgastprofessor. Er arbeitet zum Verständnis des Aufbaus und der Funktion von Ionenkanälen und auf dem Gebiet der Neurotoxine. Auch für den Stifter, das Frankfurter Unternehmen Merz GmbH & Co. KGaA, ist die Berufung von Montal ein Glücksgriff, denn auf diesen Arbeitsgebieten von Prof. Montal hat Merz in den vergangenen Jahren sehr erfolgreiche Medikamente entwickelt.
Sogenannte Ionotrope Rezeptoren sind ein für neurologische Erkrankungen wichtiger Rezeptortyp, der bestimmte Signalströme in unserem Gehirn kontrolliert, indem er je nach Rezeptorspezifikation Natrium-, Kalium-, Calcium- oder Chlorid- Ionen durch die sonst für diese Ionen nicht durchlässige Zellmembran einströmen lässt beziehungsweise überschüssige Ionen aus den Zellen ausschleust. Treten hier Störungen auf, beispielsweise wenn die rezeptor-assoziierten Ionenkanäle durch Mutationen in ihrer Struktur und Funktion verändert werden, kann dies zu Krankheiten wie Epilepsie führen. Einer dieser Kanäle ist aber auch eine prominente Zielstruktur zur Entwicklung von Medikamenten gegen die Alzheimerkrankheit.
Prof. Montal und sein Team haben hier ganz entscheidende Beiträge zum strukturellen Verständnis der Ionenkanäle geleistet – eine Voraussetzung, um gezielt gutverträgliche Medikamente zu entwickeln. Die Kanäle sind aus mehreren Proteineinheiten aufgebaut und bilden eine Membranpore. Um genauere Vorstellungen zur räumlichen Anordnung dieser Proteineinheiten in der Membran zu bekommen, entwickelten die Forscher ein hierarchisches Konzept, mit dessen Hilfe Sequenz-/ Strukturdeterminanten identifiziert wurden, die die korrekte Faltung mitbestimmen.
Experimentell nutzten die Wissenschaftler eine Methoden- Kombination aus klassischer Kernresonanzspektroskopie (NMR) und Festphasen-NMR – Methoden, die auch einen experimentellen Schwerpunkt von Arbeitsgruppen auf dem Campus Riedberg bilden. Dieser experimentelle Ansatz führte zur ersten hochaufgelösten Struktur der Kanalpore eines neuronalen Ionenkanals. Auf Basis dieser Informationen lassen sich nun Funktionsstörungen erklären, die bei bestimmten Patienten zu Epilepsie führen. So gelang es Prof. Montal, bei Patienten, die an Fieberkrämpfen oder Epilepsie litten, eine variante Form eines Na+-Kanals (Nav1.2) zu identifizieren, die aufgrund einer erworbenen Mutation in Teilen eine stark veränderte Struktur aufweist.
Für einen anderen Typ einer schwer behandelbaren Epilepsie konnte eine Variante des Natriumkanals als Ursache ausgemacht werden, die aufgrund einer Mutation nicht vollständig synthetisiert wird. Weitere Projekte beschäftigen sich mit Auswirkungen des Natriumkanals auf die normale Physiologie einer Nervenzelle. Dabei interessiert vor allem der Aspekt des neuronalen Überlebens und der Verbindung zwischen elektrischer Erregbarkeit und programmiertem Sterben neuronaler Zellen, das eines der Hauptprobleme bei der Alzheimer- und Parkinsonkrankheit ist.
Um diese Fragen auf molekularer Ebene zu studieren, wurde ein Maus-Modell entwickelt, in dem die Mäuse den in dem ersten Projekt auf struktureller Basis studierten Natriumkanal (Nav1.2) nicht mehr besitzen. Bei diesen Mäusen beobachtet man gleich nach der Geburt ein massives Sterben neuronaler Zellen – besonders von Zellen des Hirnstamms. Warum die Zellen sterben, wird in der Gruppe von Prof. Montal durch so genannte DNA-Micoarrays analysiert. Diese Methode erlaubt es, die komplexen molekularen Auswirkungen des Fehlens des Kanalproteins auf die Proteinzusammensetzung der betroffenen Zelle zu studieren. Aus der neuen Proteinzusammensetzung der Zellen erhoffen sich die Wissenschaftler nähere Erkenntnisse über die komplexen Signalwege, die ausgehend von dem Natriumkanal die Funktion und das Überleben von Hirnzellen steuern.
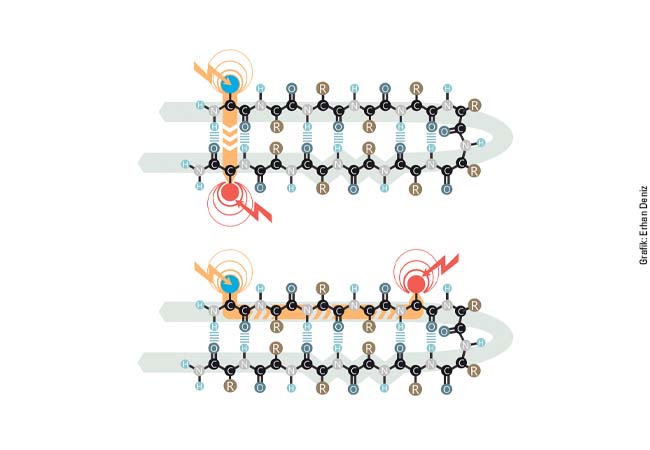
Ein weiterer Forschungsschwerpunkt von Prof. Montal liegt auf dem Gebiet der Botulinum Neurotoxine. Diese ebenso faszinierenden wie hochgiftigen Moleküle werden bereits seit vielen Jahren erfolgreich eingesetzt, um Spastiken und Dystonien, also neurologisch bedingte Muskelverkrampfungen, zu behandeln; 2005 hat auch Merz die Zulassung für ein derartiges Arzneimittel in Deutschland erhalten. Dieses neue Medikament wird mit einem bislang nicht verfügbaren hochreinen Botulinum- Neurotoxin hergestellt, das in einem aufwändigen biotechnischen Verfahren aus dem Bakterium Clostridium botulinum gewonnen wird. Die Arbeitsgruppe um Prof. Montal beschäftigt sich schon sehr lange mit der Funktion derartiger Neurotoxine.
Sie zerstören in Nervenzellen jeweils spezifisch ein bestimmtes Protein, das für die Ausschüttung des Neurotransmitters Acetylcholin erforderlich ist; Acetylcholin kann somit nicht mehr freigesetzt werden. Damit ist auch die Übertragung des Nervenimpulses für die Muskelkontraktion unmöglich; der betroffene Muskel ist gelähmt. Erst jüngst konnten die Wissenschaftler aus San Diego den Mechanismus aufklären, mit dem die so genannte schwere Kette des Botulinum Neurotoxins der leichten Kette ›hilft‹, in das Innere der Nervenzelle zu gelangen: In Analogie zu den Ionenkanälen fungiert ein Teil der schweren Kette des Botulinum Neurotoxins quasi als ein Protein- Kanal, durch den die leichte Kette sehr selektiv hindurchgeschoben wird.
Erst im Inneren der Zelle kann die leichte Kette dann als so genannte Metalloprotease das oben erwähnte Zielprotein durch Spaltung inaktivieren und so die Wirkung des Toxins entfalten. Dieser Mechanismus zeigt auch neue Möglichkeiten auf, wie man das gefährliche Botulinum-Neurotoxin durch Medikamente inaktivieren könnte. Derzeit beschäftigt sich die Arbeitsgruppe von Prof. Montal intensiv mit der Suche nach Wirkstoffen, die die schwere Kette selektiv in ihrer Funktion blockieren, um zu verhindern, dass die leichte Kette in die Zelle gelangt. Gleichzeitig wird auch nach Hemmstoffen für die leichte Kette gesucht, indem ihr Moleküle ›angeboten‹ werden, die für die leichte Kette ähnlich aussehen, wie das Zielprotein in der Zelle.