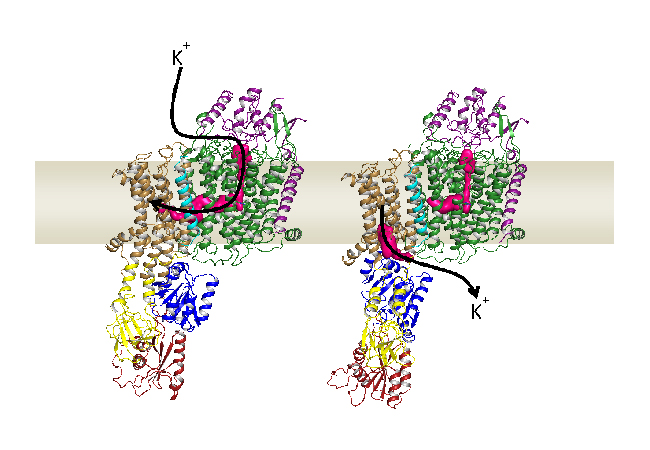
Über Jahrzehnte wurde angenommen, dass Proteinkanäle und -pumpen vollkommen unterschiedliche Funktionen erfüllen und voneinander getrennt funktionieren. Forscherinnen der Goethe-Universität und der Universität Groningen haben nun den Transportweg eines Proteinkomplexes aufgeklärt, der beide Mechanismen vereinigt: Kalium wird dort zunächst vom Kanal aufgenommen und dann an die Pumpe übergeben, von wo aus es in die Zelle transportiert wird.
Ein ausgeglichener Kalium-Haushalt ist sowohl für den Menschen wie auch für Bakterien überlebenswichtig. Da Bakterien aber viel stärkeren Schwankungen der Umweltbedingungen ausgesetzt sind, stellt die kontrollierte Kaliumaufnahme für sie oft eine besondere Herausforderung dar. Da die Zellmembran für Kalium-Ionen undurchlässig ist, muss es über spezifische Membrantransportproteine gezielt aufgenommen werden.
Zum einen ermöglichen Kaliumkanäle das schnelle, aber passive Einströmen von Kalium-Ionen. Dieses endet, sobald sich ein elektrochemisches Gleichgewicht der Zelle und der Umgebung eingestellt hat. Um darüber hinaus höhere intrazelluläre Konzentrationen zu erlangen, wird Kalium durch Kaliumpumpen aktiv in die Zelle transportiert, wobei Energie in Form von ATP verbraucht wird.
Da beide Proteinfamilien – Kanäle und Pumpen – sehr unterschiedliche Funktionen übernehmen, wurden sie bisher als voneinander unabhängig beschrieben. Das stand jedoch im Widerspruch zu der Beobachtung, dass KdpFABC, ein hochaffines, aktives Kaliumaufnahmesystem von Bakterien, keine einfache Pumpe darstellt, sondern aus insgesamt vier unterschiedlichen Proteinen aufgebaut ist. Eines davon leitet sich von einer typischen Pumpe ab, während ein weiteres einem Kaliumkanal ähnelt.
Inga Hänelt, Juniorprofessorin für Biochemie an der Goethe-Universität, und ihre Kollegin Cristina Paulino von der Rijksuniversiteit Groningen, Niederlande, nahmen das Membranprotein KdpFABC deshalb genauer unter die Lupe bzw. das Kryo-Elektronenmikroskop. Das Ergebnis überraschte sie: „Alle früheren Hypothesen waren falsch“, erklärt Inga Hänelt. „Obwohl wir alle Daten vorliegen hatten, hat es eine Weile gedauert, bis wir verstanden haben, welchen Weg das Kalium tatsächlich durch den Komplex in die Zelle hineinnimmt.“
Zunächst bindet ein Kanal-ähnliches Protein das Kalium und reicht es dann durch den ersten Tunnel an die Pumpe weiter. Dort angekommen wird der erste, auswärtsgerichtete Tunnel verschlossen, während sich ein zweiter, einwärtsgerichteter Tunnel öffnet. Dieser erstreckt sich ebenfalls zwischen beiden Proteinen und endet schließlich im Inneren der Zelle. „Der Komplex vereint quasi die besten Eigenschaften beider Proteinfamilien“, erklärt Charlott Stock, Doktorandin in der Arbeitsgruppe von Inga Hänelt. „Das Kanal-ähnliche Protein bindet Kalium zunächst sehr spezifisch und mit hoher Affinität, während die Pumpe den aktiven Transport ermöglicht, wodurch das Kalium in der Zelle bis zu 10.000-fach angereichert werden kann.“
Die kürzlich in Nature Communications publizierten Daten verdeutlichten den Wissenschaftlerinnen eindrucksvoll, wie vielfältig Transporte über Membranen sein können. „Wir haben daraus gelernt, uns bei der Erforschung verschiedener Membrantransportproteine nicht auf scheinbar unumstößliche Mechanismen festzulegen, sondern offen für Überraschungen zu sein“, fasst Inga Hänelt zusammen.
[dt_call_to_action content_size=”small” background=”fancy” line=”true” animation=”fadeIn”]
Publikation: Charlott Stock, Lisa Hielkema, Igor Tascon, Dorith Wunnicke, Gert T. Oostergetel, Mikel Azkargorta, Cristina Paulino, Inga Hänelt, Cryo-EM structures of KdpFABC suggest a K+ transport mechanism via two inter-subunit half-channels, in: Nature Communications,10.1038/s41467-018-07319-2
[/dt_call_to_action]
Quelle: Pressemitteilung vom 26. November 2018