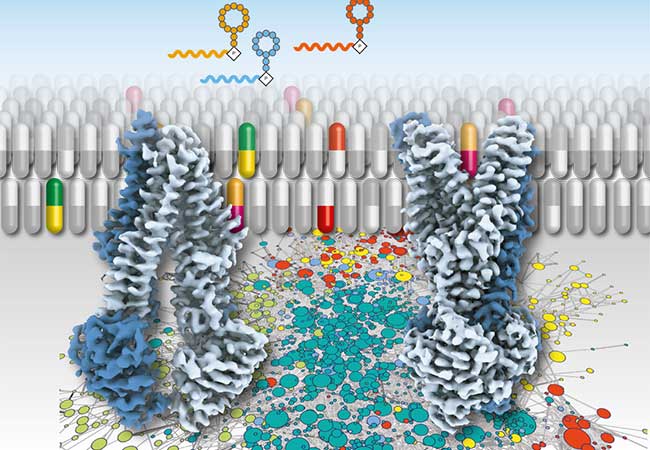
Ob Bakterien gegen Antibiotika resistent sind, entscheidet sich oft an ihrer Zellmembran. Dort können Antibiotika auf dem Weg ins Zellinnere blockiert oder von innen nach außen katapultiert werden. Makrozyklische Peptide, eine neuartige Klasse von Antibiotika, bioaktiver Zellgifte und Hemmstoffe (Inhibitoren), geben Aufschluss darüber, wie dieser Transportprozess an der Membran verläuft, wie er beeinflusst wird und wie er genutzt werden kann, um die Resistenz einer bösartig transformierten Zelle zu umgehen. Die Forschungsergebnisse, die hierzu unter der Leitung von Prof. Dr. Robert Tampé (Goethe-Universität) und von Prof. Dr. Hiroaki Suga (Universität Tokyo) erarbeitet wurden, werden in dem renommierten Journal eLife veröffentlicht (20-02-2021-RA-eLife-67732).
FRANKFURT. Es gibt zurzeit nur wenige synthetische Wirkstoffe, die an die weit verbreiteten Membrantransportproteine, den ATP-Bindungskassettentransportern (ABC), binden und diese blockieren. Vier dieser makrozyklischen Peptide haben Wissenschaftler der Goethe-Universität und der Universität von Tokyo als Modelle für eine neuartige Generation von Wirkstoffen identifiziert. Dabei kamen Methoden zur Anwendung, für die die beteiligten Wissenschaftlerinnen und Wissenschaftler als weltweit führend gelten.
Dank Deep Sequencing, einem extrem schnellen und effizienten Ausleseverfahren, konnten die gewünschten makrozyklischen Peptide aus einer Billionen Varianten umfassenden “Bibliothek” makrozyklischer Peptide herausgefiltert werden – diese Zahl übersteigt die Anzahl an Sternen in der Milchstraße. Dass überhaupt eine solch enorme Anzahl vorliegt, hängt mit einem neuartigen Verfahren zusammen: Durch Reprogrammierung des genetischen Codes können Aminosäuren gezielt als Wirkstoffbauteile verwendet werden, die sonst in der Zelle nicht genutzt werden. Vor allem durch ihre kreisförmige, geschlossene Struktur unterscheiden sie sich von natürlichen Proteinen. “Weil diese Therapeutika zyklisch sind, werden sie in der Zelle weniger schnell abgebaut”, erklärt Robert Tampé, Direktor des Instituts für Biochemie an der Goethe-Universität. “Außerdem sind die ringförmigen Wirkstoffe in ihrer Raumstruktur eingeschränkt, sie binden deshalb ohne große Umlagerungen an das Zielmolekül.” Ein drittes Unterscheidungsmerkmal macht die makrozyklischen Peptide ganz besonders attraktiv für die Wissenschaftler:innen: Bei der Herstellung der Wirkstoffe wird ihre Bauanleitung als “Barcode” mitgeliefert. Sucht man in einer Anzahl von Billionen synthetisch erzeugter Therapeutika bestimmte heraus, führen sie ihr “Namensetikett” gleichsam mit sich.
Welche Rolle spielen nun die synthetischen Therapeutika für die Antibiotikaresistenz in Bakterien oder die Multidrogenresistenz von Tumorzellen? Was geschieht, wenn sie auf das ATP-getriebene Transportmolekül treffen, das für die Resistenz verantwortlich ist, indem es die Chemotherapeutika aus der Zelle befördert? Kurz zusammengefasst: Die Wirkstoffe blockieren den Transporter, indem sie an ihn binden. Dies kann am Anfang oder am Ende eines Transportprozesses geschehen, wenn sich der Transporter im Ruhzustand befindet. Da die Wissenschaftler:innen den Transportprozess aber verlangsamen können, so dass er wie in Zeitlupe abläuft, können die Wirkstoffe identifiziert werden, die mitten im Transportprozess “einsteigen” und das Membranprotein in seiner jeweiligen Position “festhalten“. So erhalten die Forscher:innen einen Einblick in die Choreographie des Transportprozesses wie durch die Bilder eines Filmstreifens.
Diese Einblicke haben in der Wissenschaft bereits zu einem “Paradigmenwechsel” geführt, wie Tampé erklärt: „Bislang sind wir davon ausgegangen, dass die ATP-Hydrolyse (Anm: ein Energie freisetzender Spaltprozess) die Energie für den Transport durch die Membran liefert. Dies ist aber nur indirekt der Fall. Es ist das Ereignis der Bindung des ATP-Moleküls, das Substanzen aus der Zelle stößt. Die Energie der Hydrolyse wird dagegen dafür eingesetzt, den ABC-Transporter wieder in seinen Ausgangszustand zu versetzen.” Diese und andere Einblicke in das Membrangeschehen, so die Überzeugung der Arbeitsgruppen an der Goethe-Universität und der Universität Tokyo, zeigen Wege auf, wie zukünftige Arzneimittel entwickelt werden können.
Die Grundlagenforschung zu zellulären Membranen und Membranproteinen hat in Frankfurt bereits eine lange Tradition. Robert Tampé klärte wesentliche Mechanismen von ATP-getriebenen Transportproteinen und zellulären Maschinerien der adaptiven Immunantwort und Qualitätskontrolle, die gemeinsam mit der neuen Publikation Ansätze für die angewandte Arzneimittelforschung liefern können. Nachdem Tampé Sprecher des Ende 2020 ausgelaufenen Sonderforschungsbereichs »Transport und Kommunikation über biologische Membranen« (SFB 807) war, befindet sich das Konzept für ein neues Forschungszentrum bereits in der Entwicklung. Dabei sollen hochdynamische Prozesse in Bezug auf Proteinnetzwerke und Maschinerien in zellulären Membranen erforscht werden. Langfristig sollen die Forschungsergebnisse neue Möglichkeiten für die Therapie von molekularen Krankheiten, Infektionen und Krebs aufzeigen.
Publikation: Erich Stefan, Richard Obexer, Susanne Hofmann, Khanh Vu Huu, Yichao Huang und Nina Morgner, zudem federführend Hiroaki Suga und Robert Tampé: „De novo macrocyclic peptides dissect energy coupling of a heterodimeric ABC transporter by multimode allosteric inhibition“ (20-02-2021-RA-eLife-67732)
Stefan, Hofmann und Tampé forschen am Institut für Biochemie der Goethe-Universität, Vu Huu und Morgner am Institut für Physikalische und Theoretische Chemie der Goethe-Universität und Obexer, Huang und Suga am Department of Chemistry, University of Tokyo.
https://elifesciences.org/articles/67732