Die Französin Emmanuelle Charpentier und die Amerikanerin Jennifer A. Doudna haben am 14. März den mit 100 Tausend Euro dotierten Paul Ehrlich- und Ludwig Darmstaedter-Preis erhalten. Die Wissenschaftlerinnen wurden für ihre bahnbrechenden Arbeiten zur Entwicklung der programmierbaren Genschere CRISPR-Cas9 geehrt. Mit diesem Präzisionswerkzeug können Gene mühelos und mit großer Genauigkeit bearbeitet werden.
„Diese Entdeckung ist vermutlich ähnlich weitreichend wie seinerzeit die Entdeckung des Klonierens, des Sequenzierens und der PCR“, urteilte Prof. Harald zur Hausen, Vorsitzender des Stiftungsrats der Paul Ehrlich-Stiftung, bei der Preisverleihung in der Frankfurter Paulskirche. Er zählte die Genschere zu den erfolgreichsten Verfahren der Molekularbiologie der vergangenen zehn oder gar 20 Jahre. Die Preisträgerinnen hätten dieses Potential erkannt, aufgezeigt und weitreichende Anwendungen ermöglicht. CRISPR-Cas9 ist seit der Publikation im August 2012 zu einem der gefragtesten Werkzeuge in der molekularbiologischen Forschung avanciert.
„Die CRISPR-Technologie wird vermutlich helfen, Erbkrankheiten zu kurieren, gefährliche Keime auszurotten und gerade für die Notgebiete der Erde produktive Pflanzen zu züchten“, so Prof. Harald zur Hausen zu künftigen Anwendungen des Verfahrens.
„Die Genschere ist so einfach zu bedienen, dass sie quasi jeder Wissenschaftler mit molekularbiologischem Sachverstand bedienen kann“, erklärte Jennifer Doudna, Professorin an der Universität of California in Berkeley, den Erfolg von CRISPR Cas auf der Pressekonferenz vor der Preisverleihung. So ist das noch vor Jahren äußerst schwierige Editieren des Genoms inzwischen zu einem Routineverfahren geworden, mit dem auch in die Keimbahn eingegriffen werden kann. Gefragt nach ihrer ethischen Position zu dieser Möglichkeit verwiesen beide Forscherinnen auf im Dezember 2015 in Washington abgehaltenen Ethikgipfel. Dort entschieden sich die teilnehmenden Forscher gegen das Editieren der menschlichen Keimbahn für klinische Zwecke. Zurzeit gebe es ohnehin nicht viele klinische Anwendungen für die CRISPR-Technologie, gab Emmanuelle Charpentier, Direktorin am Max-Planck-Institut für Infektionsbiologie in Berlin, zu bedenken.
Die beiden Laureatinnen haben als Erste gezeigt, dass die zum bakteriellen Immunsystem gehörende Genschere aus Streptococcus pyogenes derart mit DNA-Koordinaten programmiert werden kann, dass sie die adressierte Position auf der DNA auch tatsächlich findet und zerschneidet. Die Anwendungsmöglichkeiten sind enorm: CRISPR-Cas9 können Gene ausgeschaltet, verändert oder durch andere Gene ersetzt werden. Man kann mit dieser Genschere jeden zellulären Bauplan überarbeiten. Durch dieses schnelle Redigieren und Editieren der DNA lässt sich leichter und genauer als je zuvor erfassen, wie sich die einzelnen genetischen Veränderungen auf die Entstehung von Krankheiten oder die Entwicklung eines Organismus auswirken. Es wird daher erwartet, dass sich bald neue Therapien gegen Erbkrankheiten und Krebs ergeben werden.
Bei Mäusen ist die CRISPR-Technologie bereits dazu verwendet worden, Mutationen zu korrigieren, die eine Lebererkrankung oder eine muskuläre Dystrophie auslösen, was zu neuen Therapien führen könnte. Benutzt hat man die CRISPR-Technologie auch bei Ratten, Taufliegen, Zebrafischen, Fröschen, Affen, Pilzen, menschlichen Stammzellen und bei vielen Pflanzen.
Genschere stammt aus dem bakteriellen Immunsystem
 Woher kommt CRISPR-Cas9? Die Genschere gehört zum bakteriellen Immunsystem. Bakterien und Archebakterien wehren sich damit gegen Bakteriophagen. Das sind Viren, die sich auf Bakterien spezialisiert haben. Falls die Bakterien ihre erste Begegnung mit einem Bakteriophagen überleben, bauen sie ein kurzes Stück seiner DNA in ihr Erbgut ein, quasi als molekulares Erinnerungsfoto an den unterlegenen Feind. Die Stelle im Erbgut, wo sie diese Trophäen hinterlegen, heißt CRISPR-Locus für „clustered regulatory interspaced short palindromic repeats“. Daher rührt auch der eigenartige Name dieser Genschere. Jeder dort hinterlegte DNA-Schnipsel ist zum Abschuss freigegeben, falls sich der dazugehörige Phage noch einmal zeigt. Das Bakterium sucht deshalb ständig nach den im CRISPR-Locus hinterlegten Bedrohungen. Dazu werden die aneinandergereihten DNA-Schnipsel in eine Ribonukleinsäure übersetzt, die dann in viele kleine Fragmente zerschnitten wird. Emmanuelle Charpentier beschrieb bereits 2011 die beiden Komponenten des CRISPR-Cas9 Systems im Bakterium Streptococcus pyogenes und zeigte, dass das System wie ein Präzisionsskalpell arbeitet.
Woher kommt CRISPR-Cas9? Die Genschere gehört zum bakteriellen Immunsystem. Bakterien und Archebakterien wehren sich damit gegen Bakteriophagen. Das sind Viren, die sich auf Bakterien spezialisiert haben. Falls die Bakterien ihre erste Begegnung mit einem Bakteriophagen überleben, bauen sie ein kurzes Stück seiner DNA in ihr Erbgut ein, quasi als molekulares Erinnerungsfoto an den unterlegenen Feind. Die Stelle im Erbgut, wo sie diese Trophäen hinterlegen, heißt CRISPR-Locus für „clustered regulatory interspaced short palindromic repeats“. Daher rührt auch der eigenartige Name dieser Genschere. Jeder dort hinterlegte DNA-Schnipsel ist zum Abschuss freigegeben, falls sich der dazugehörige Phage noch einmal zeigt. Das Bakterium sucht deshalb ständig nach den im CRISPR-Locus hinterlegten Bedrohungen. Dazu werden die aneinandergereihten DNA-Schnipsel in eine Ribonukleinsäure übersetzt, die dann in viele kleine Fragmente zerschnitten wird. Emmanuelle Charpentier beschrieb bereits 2011 die beiden Komponenten des CRISPR-Cas9 Systems im Bakterium Streptococcus pyogenes und zeigte, dass das System wie ein Präzisionsskalpell arbeitet.
Charpentier und Doudna haben erkannt, dass man diese von den Bakterien zur Abwehr von Phagen entwickelte Genschere dazu benutzen kann, jede beliebige DNA-Sequenz anzusteuern und zu zerschneiden. Programmiert und dirigiert wird die Genschere über eine Führungs-RNA. Zu Charpentiers und Doudnas Leistungen gehört auch, dass sie die Genschere einfacher und bedienungsfreundlicher gemacht haben, indem sie die beiden RNAs, mit denen die Bakterien die Schere auf Trapp bringen, zu einer einzigen Führungs-RNA zusammengeführt haben. Es hat sich dann schnell gezeigt, dass diese vereinfachte Form nicht nur im Reagenzglas funktioniert. Schon wenige Monate nach der Veröffentlichung dieser bahnbrechenden Entdeckung im August 2012 haben Feng Zhang und George Church gezeigt, dass CRISPR Cas9 auch in lebenden humanen Zellen funktioniert. Doudna hat drei Wochen später ebenfalls Ergebnisse zum Einsatz von CRISPR-Cas 9 in menschlichen Zellen veröffentlicht.
Genschere über Führungs-RNA programmiert
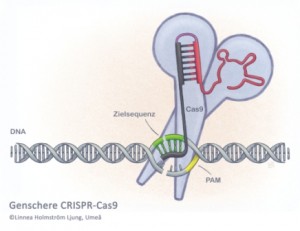
Wie findet CRISPR-Cas9 die zum Zerschneiden freigegeben Fremd-DNA? Auf der Suche nach der komplementären DNA gleitet der Komplex aus Cas9 und der Führungs-RNA wie ein Schlitten über den DNA-Doppelstang und stoppt immer dann, wenn er auf ein kurzes Sequenz-Motiv mit dem Namen PAM trifft. Bei jedem Halt wird geprüft, ob die mitgeführte Führungssequenz mit der Sequenzumgebung des PAM-Motivs identisch ist. Trifft das zu, wird die DNA an der Stelle zerschnitten. Passt die Sequenz nicht zu der mitgeführten Sequenz, sucht die Genschere weiter, bis sie fündig wird. Editiert und redigiert wird das Genom bei der Reparatur der offenen Doppelstrang-Enden nach dem Zerschneiden der DNA. Mit der CRISPR-Technologie kann das Erbgut auch an mehreren Stellen gleichzeitig überarbeitet werden. Allerdings kann die sogenannte Off-Target-Aktivität Probleme machen. Dieser Begriff beschreibt den Umstand, dass der Komplex aus Cas9 und der Führungs-RNA den Doppelstrang nicht an der vorgesehenen Stelle im Genom schneidet, sondern an ähnlichen Stellen. Die Forscher arbeiten derzeit an Lösungen. Eine besteht darin, die Genschere sehr genau zu dosieren und so wenig wie möglich zum Editieren des Genoms zu verwenden. Je weniger von der Genschere in der Zelle präsent ist, desto weniger Fehler macht sie. „Wenn CRISPR-Cas9 in angemessenen Mengen verwendet wird, ist die Off-Target Aktivität praktisch nicht nachweisbar“, sagt Doudna. „Wir sind allerdings im Moment noch nicht in der Lage die Off-Target Aktivität kategorisch auszuschließen“, ergänzt Charpentier.
Genschere wirft ethische Fragen auf
Weil sich mit CRISPR-Cas9 quasi jedes Erbgut überarbeiten lässt, kann auch die menschliche Keimbahn redigiert werden, was die Veränderungen erblich macht. Damit ist die generationenübergreifende Veränderung des menschlichen Erbguts keine Fantasie mehr. Im April 2015 editierte Junjiu Huang von der Guangdong Universität zum ersten Mal menschliche Embryonen mit CRISPR-Cas9. Zwar waren die Embryonen von Anfang an nicht lebensfähig, weil sie statt der üblichen zwei Chromosomensätze drei Chromosomensätze hatten, aber es wurde deutlich, was grundsätzlich machbar ist, auch wenn der Prozess noch sehr ineffizient war. Huang hat versucht, das Gen für B-Thalässemie auszutauschen, einer erblichen Bluterkrankung. Seine Veröffentlichung hat die schon zuvor eingesetzte ethische Debatte enorm befeuert. Im Dezember 2015 trafen sich viele renommierte Wissenschaftler unter dem Vorsitz von vier bedeutenden Wissenschaftsakademien in Washington zum „International Summit on Human Gene Editing“. In der verabschiedeten Schlusserklärung wird das Editieren der Keimbahn solange als unverantwortlich betrachtet, wie es ethische und sicherheitsrelevante Vorbehalte gibt. Außerdem sei eine breite gesellschaftliche Akzeptanz dafür nötig, heißt es in dem Schlussdokument weiter. Damit fordert es kein Moratorium, sondern die Intensivierung der Forschung innerhalb der gesetzlichen und ethischen Grenzen, um die Vorteile und Risiken des Genom-Editierens auszuloten. In dem Dokument heißt es weiter, dass derzeit nichts für eine Keimbahntherapie spreche. Es gebe viele Sicherheitsbedenken, gesetzliche Grenzen und keine Notwendigkeit, da die Präimplantationsdiagnostik schon jetzt Eltern mit Erbkrankheiten zu einem gesunden Kind verhelfe. „Es gibt einfach zu viele unbeantwortete Fragen, die noch adressiert werden müssen“, sagt Charpentier. „Ich glaube, dass eine Keimbahntherapie derzeit vermeidbar ist.“ Auch Doudna spricht sich gegen eine Keimbahntherapie für klinische Zwecke zum derzeitigen Zeitpunkt aus.
Der Paul Ehrlich und Ludwig Darmstaedter-Preis gehört zu den international renommiertesten Auszeichnungen, die in der Bundesrepublik auf dem Gebiet der Medizin vergeben werden. Jennifer Doudna erinnerte sich in ihrer Dankesrede an ihren ersten Kontakt mit den Theorien des Frankfurter Nobelpreisträgers Paul Ehrlich. Ihr Vater habe ihr als Mädchen oft Bücher über Naturwissenschaften geschenkt, weil er ihr Interesse dafür bemerkte. Einer der ersten Titel, der auf ihrem Nachttisch lag, war “Dr. Ehrlich’s Magic Bullet”. Darin wurden Paul Ehrlichs Arbeiten zu einer spezifischen medikamentösen Therapie erklärt.
„Ich war begeistert von der Idee, chemisches Wissen anzuwenden, um die Biologie zu verstehen. Diese Idee hat mich in meiner späteren Forschung begleitet und dazu geführt, Biochemie zu studieren und die Roller der RNA in Zellen zu untersuchen“, sagte Doudna in ihrer Dankesrede.
[dt_call_to_action content_size=“small“ background=“fancy“ line=“true“ animation=“fadeIn“]

Emmanuelle Charpentier (47) studierte Mikrobiologie, Genetik und Biochemie in Paris und promovierte am Institut Pasteur. Nach Stationen in New York – unter anderem an der Rockefeller University – und in Memphis wechselte Charpentier 2002 an die Universität Wien und von dort 2009 an die Universität Umeå, wo sie noch immer Gastprofessorin ist. Charpentier kam 2013 im Rahmen einer Humboldt Professur nach Deutschland. Sie leitete zunächst eine Forschungsabteilung am Helmholtz-Zentrum für Infektionsforschung in Braunschweig und war Professorin an der medizinischen Hochschule Hannover. Seit Oktober 2015 ist sie Direktorin am Max-Planck-Institut für Infektionsforschung in Berlin. Charpentier ist mit weit mehr als zwei Dutzend Preisen ausgezeichnet worden. Sie erhielt unter anderem den mit 3 Millionen Dollar dotierten Breakthrough Prize in Life Sciences, den Leibniz-Preis der Deutschen Forschungsgemeinschaft und die Ehrendoktorwürde der Universität Leuven. Charpentier ist Mitglied in verschiedenen Wissenschaftsakademien und Fachgesellschaften, unter anderem der Nationalen Akademie der Wissenschaften Leopoldina. Sie ist auch gewähltes ausländisches Mitglied der Königlich-Schwedischen Akademie der Wissenschaften. 2014 hat sie die Firma CRISPR Therapeutics mitbegründet, 2013 die Firma ERS Genomics.
[/dt_call_to_action]
[dt_call_to_action content_size=“small“ background=“fancy“ line=“true“ animation=“fadeIn“]

Jennifer A. Doudna (52) wurde studierte Chemie am Pomona College in Kalifornien und promovierte 1989 in Biologischer Chemie und Molekularer Chemie an der Harvard Universität. Nach der Promotion wechselte Doudna an die Universität Colorado. 1994 ging sie als Professorin nach Yale. Seit 2002 ist Doudna Professorin an der Universität Berkeley in Kalifornien. Sie forscht seit 1997 mit der Förderung des Howard Hughes Medical Institutes. Sie hat viele Auszeichnungen erhalten, unter anderem den mit 3 Millionen Dollar dotierten Breakthrough Prize in Life Sciences. Doudna ist Mitglied in verschiedenen Wissenschaftsakademien und Fachgesellschaften, unter anderem der National Academy of Sciences, der National Academy of Medicine, der National Academy of Inventors und der American Academy of Arts and Sciences. Doudna ist Mitbegründerin von Editas Medicine, Intellia Therapeutics und Caribou Biosciences.
[/dt_call_to_action]