[vc_row][vc_column][vc_column_text css=“.vc_custom_1454492047834{margin-bottom: 20px !important;}“]Pflanzen, aber auch einige Bakterien und Archäen verfügen über hocheffiziente Mechanismen, Licht in Energie umzuwandeln. Photovoltaik-Zellen reichen an die Perfektion dieser natürlichen Systeme noch lange nicht heran. Deshalb versuchen Forscher, mit ultraschnellen spektroskopischen Methoden der Natur in die Karten zu schauen und von ihr zu lernen.
Die Energieversorgung für die immer weiter wachsende Weltbevölkerung zu sichern, ist eine zentrale Herausforderung unserer modernen Gesellschaft. Einen wichtigen Beitrag dazu leistet die optimierte Nutzung der Energie, beispielsweise durch effiziente, leichte Speichermedien für Elektroautos, Mobiltelefone oder Laptops. Ebenso wichtig ist der verlustarme und umweltfreundliche Transport zum Verbraucher. Das Hauptaugenmerk liegt aber nach wie vor auf dem Energiesparen, auf effizienteren Prozessen bei der Erzeugung elektrischer Energie in zentralen Großkraftwerken (Gas, Kohle, Kernenergie, Windparks, Wasserkraft) oder lokalen Quellen (Erdwärme, Biogas, Solarthermie, Photovoltaik). Dabei basieren alle regenerativen Energiequellen (mit Ausnahme der Gezeitenkraftwerke und Windparks) letztendlich auf der Energie der Sonne.
Das verlockendste Konzept ist zweifellos die direkte Umwandlung von Sonnenlicht in elektrische Energie, was in der Photovoltaik inzwischen auch auf großen Flächen in Deutschland realisiert wird. Der typische Wirkungsgrad einer kommerziellen Solarzelle auf Siliziumbasis beträgt circa 20 Prozent und liegt damit weit unter dem Wirkungsgrad biologischer Systeme. Die Evolution hat über viele Millionen Jahre das Konzept der Photosynthese optimiert und an verschiedene Organismen und deren spezifische Lebensbedingungen angepasst. Dabei hat sie zwei grundlegende Konzepte der natürlichen Photosynthese hervorgebracht: die (Bacterio-)chlorophyllbasierten Systeme und die Retinalbasierten Systeme. Die chlorophyllbasierten Systeme zeichnen sich durch eine herausragende Quantenausbeute von nahezu 100 Prozent aus. Die Quantenausbeute der Retinal-basierten Systeme ist mit etwa 60 Prozent etwas geringer, dafür sind sie aber mit ihrem Bauprinzip universell einsetzbar. Diese beiden Hauptgruppen stellen wir im Folgenden kurz vor. Insbesondere erklären wir, durch welche Konzepte die hohen Wirkungsgrade von der Natur realisiert wurden.
Licht trennt Ladungen
Alle künstlichen Photovoltaik- oder biologischen Photosynthese-Systeme basieren auf dem grundlegenden Konzept, Licht in elektrische Energie umzuwandeln: Ein absorbiertes Photon transportiert einen Ladungsträger (Elektron oder Proton) und trägt damit zum Aufbau eines elektrochemischen Potenzials über die Zellmembran bei. In der künstlichen Photovoltaik kann die entstehende Spannung direkt benutzt werden, um beispielsweise ein elektrisches Gerät zu betreiben, während sie bei biologischen Organismen zur Synthese energiereicher biochemischer Verbindungen genutzt wird. Die Echtzeitbeobachtung dieser ultraschnellen, lichtinduzierten Ladungstrennung und das daraus resultierende molekulare Verständnis der Photoreaktionen in natürlichen Systemen ist ein zentrales Forschungsthema unserer Arbeitsgruppe.
[dt_call_to_action content_size=“small“ background=“fancy“ line=“true“ animation=“fadeIn“]
Auf den Punkt gebracht
- Die natürlichen Systeme zur Photosynthese basieren einerseits auf dem Blattgrün Chlorophyll und Carotinoiden, andererseits auf Rhodopsinen, die mit dem menschlichen Sehpigment verwandt sind.
- Photoreaktionen laufen in mehreren, teilweise sehr schnellen Zwischenschritten ab. Sie können mit der Anreg-Abtast-Spektroskopie aufgeklärt werden, die ähnlich wie ein Stroboskop funktioniert.
- Eine technische Alternative zur Photovoltaik auf Siliziumbasis ist die Grätzelzelle, die, ähnlich der Photosynthese, Farbstoffmoleküle verwendet.
[/dt_call_to_action]
Dass man diese großen biochemischen Systeme heute versteht, ist maßgeblich der genauen Aufklärung ihrer Struktur zu verdanken. Die wichtigsten experimentellen Methoden sind die Röntgenkristallografie, die Kernspinresonanz und die Elektronenmikroskopie. Diese Methoden sind an der Goethe-Universität und den Frankfurter Max-Planck-Instituten in hervorragender Weise vertreten, nicht zuletzt durch Prof. Hartmut Michel, der für die Röntgen-Strukturaufklärung des photosynthetischen Reaktionszentrums von Purpurbakterien zusammen mit Johann Deisenhofer und Robert Huber 1988 den Nobelpreis für Chemie erhielt.
Antennen ernten Licht mit Farbstoffen
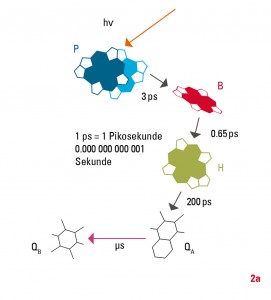
Organismen, die chlorophyllbasierte Photosynthese betreiben, findet man fast überall auf der Erde: Sie reichen von Bakterien über Algen bis hin zu höheren Pflanzen. Aus der Vielfalt dieser Systeme stellen wir beispielhaft das bakterielle Reaktionszentrum vor, in dem die eigentliche Umwandlung der Lichtenergie in elektrische Energie stattfindet. Das Reaktionszentrum ist meist umgeben von ausgedehnten Antennenkomplexen, die lichtempfindliche Farbstoffe (Chromophore) enthalten. In diesem Fall sind dies Bacteriochlorophyll (Blattgrün) und die gelb bis rötlich gefärbten Carotinoide. Aufgabe der Antennen ist es, Licht möglichst effektiv zu absorbieren und die elektronische Anregungsenergie schnell zum Reaktionszentrum weiterzuleiten, bevor sie in Form von Fluoreszenz oder als Wärme verloren geht. Tatsächlich geschehen die Energietransferschritte ultraschnell, und zwar in wenigen Pikosekunden (1 ps = 10-12 Sekunden).
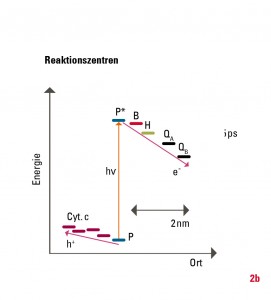
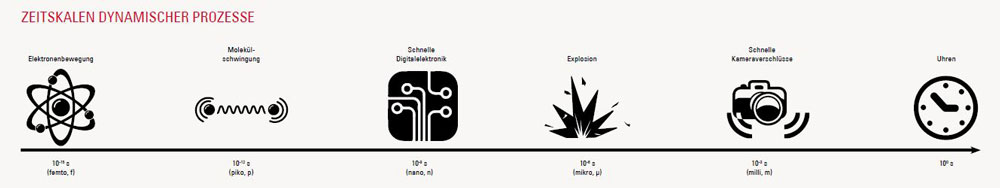
Die eigentliche Ladungstrennung geschieht in der Zellmembran in einem mehrstufigen Prozess (Abb. 2): Zunächst wird die Anregungsenergie vom »special pair«, einem Dimer aus zwei Bacteriochlorophyllmolekülen (P), genutzt, um ein Elektron über mehrere Zwischenstufen auf ein Chinon QB zu übertragen. Nach erneuter Belichtung und dem Übertrag eines weiteren Elektrons wird das Chinon protoniert (QB+2e- +2H+→QBH2) und verlässt als Hydrochinon das Reaktionszentrum. Ein weiteres Transmembranprotein (in Pflanzen: Cytochrom-b6f-Komplex, in Bakterien: Cytochrom-bc1-Komplex) baut mit diesem Hydrochinon den Protonengradienten über die Membran auf. Der Elektronenfluss ist dabei zyklisch, das heißt, die Elektronen werden über redoxaktive Proteine wieder auf das Reaktionszentrum zurückübertragen. Die Einzelschritte, das heißt die Zwischenprodukte und deren Bildungs- und Zerfallsraten, sind in den letzten 30 Jahren durch verschiedene experimentelle Methoden aufgeklärt worden. Bei den hier relevanten ultraschnellen Reaktionen nimmt die Methode der Anreg-Abtast-Spektroskopie mit ultrakurzen Lichtimpulsen im Zeitbereich weniger Femtosekunden (1 fs = 10-15 Sekunden) eine zentrale Stellung unter den experimentellen Methoden ein.
[/vc_column_text][ultimate_heading main_heading=“Methoden und Ergebnisse der Ultrakurzzeit-Laserchemie“ heading_tag=“h3″ alignment=“left“ margin_design_tab_text=““ main_heading_margin=“margin-bottom:-20px;“][/ultimate_heading][vc_accordion active_tab=“false“ title_size=“h4″ style=“2″][vc_accordion_tab title=“Anreg-Abtast-Spektroskopie“][vc_column_text]
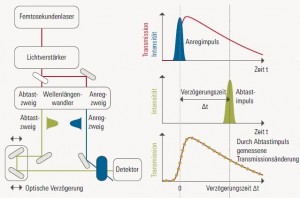
Mit der Anreg-Abtast-Spektroskopie lässt sich der zeitliche Verlauf einer schnellen Reaktion verfolgen, die mit Licht ausgelöst werden kann (zum Beispiel die Photosynthese). Die Reaktion könnte dabei durchaus mehrstufig über (kurzlebige)Zwischenprodukte verlaufen, die schnell weiterreagieren, etwa A → A* → B → C. In diesem Beispiel wird das Edukt A über Lichtabsorption in den angeregten Zustand A* gebracht, dann wird mit der Halbwertszeit τ1 das Zwischenprodukt B gebildet, dieses reagiert mit der Halbwertszeit τ2 weiter zum finalen Produkt C. Alle diese Produkte A, A*, B und C haben im Allgemeinen unterschiedliche Absorptionsspektren. Liegt die Zeit für einen der Reaktionsschritte im Bereich von Nanosekunden (1 ns = 10-9 Sekunden) oder kürzer, kann man den Reaktionsverlauf mit schnellen elektronischen Detektionsmethoden nicht mehr ohne Weiteres messen. Hier wird die Anreg-Abtast-Spektroskopie angewendet.
Das Anreg-Abtast-Spektrometer stellt dem Experimentator zwei ultrakurze Laserpulse (typischerweise mit einer Pulslänge von tpuls < 100 fs) zur Verfügung, welche in ihrer Farbe unabhängig veränderbar sind und deren zeitlicher Abstand Δt zwischen 0 fs und 1 ns frei wählbar ist. Beide Pulse werden auf die zu untersuchende Probe (mit Edukt A) eingestrahlt.
Der erste Laserpuls ist typischerweise sehr energiereich und so gewählt, dass er vom Edukt A absorbiert wird und eine große Menge des angeregten Produkts A* entsteht. Eine gewisse Zeit Δt später wird der zweite Laserpuls (typischerweise spektral breit und viel schwächer als der erste Puls) auf die Probe eingestrahlt und das transmittierte Licht mit einem Spektrometer aufgezeichnet. Dadurch wird das Absorptionsspektrum der Probe zum Zeitpunkt Δt nach Reaktionsbeginn aufgenommen. Dieses Experiment wird nun mit einer frischen, identischen Probe wiederholt, aber mit einer anderen zeitlichen Verzögerung Δt. Setzt man alle diese Experimente zusammen, hat man den zeitlichen Verlauf der Reaktion nachgewiesen.
Durch diese Herangehensweise ist die zeitliche Auflösung der Daten nicht durch die Geschwindigkeit der verwendeten Messelektronik begrenzt, sondern sie wird von der Kürze der verwendeten Laserpulse bestimmt.Derselbe Trick wird bei der Beobachtung eines Objekts mit einem Stroboskop oder einer Kamera mit Blitzlicht verwendet: Der jeweilige Detektor (beim Stroboskop das Auge, bei der Kamera der Film beziehungsweise CCD-Chip) ist relativ träge, aber durch die Beleuchtung der Szenerie mit einem kurzen intensiven Lichtblitz wird das Objekt nur in diesem Moment aufgezeichnet.[/vc_column_text][/vc_accordion_tab][vc_accordion_tab title=“Zeitaufgelöste Veränderung der Absorption von Proteorhodopsin“][vc_column_text]
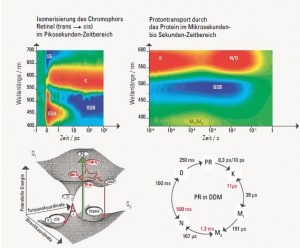
Die Signale sind über zwölf Größenordnungen in der Zeit aufgenommen. Farbcode: rot = Absorptionszunahme, blau = Absorptionsabnahme, grün = keine Absorptionsänderung.
Das Bild links oben zeigt die Messung der zeitaufgelösten Absorption mit der Anreg-Abtast-Spektroskopie. Im Zeitbereich von Pikosekunden bis Nanosekunden sind vier Signale sichtbar. Unmittelbar mit der optischen Anregung des Proteorhodopsins (PR) bleicht der Grundzustand aus (GSB, groundstate bleach). Dadurch entsteht ein negatives Signal. Die stimulierte Emission (SE, negatives Signal) und die induzierte Absorption des angeregten Zustands (ESA, excited state absorption, positives Signal) sind mit dem optisch angeregten Zustand PR* von Proteorhodopsin verknüpft. Die zeitliche Abnahme dieser Signale mit den Zeitkonstanten 0,3 ps und 10 ps zeigt die Lebensdauer von PR* an.Die Produktabsorption K (positives Signal) steigt mit den Zeitkonstanten 0,3 ps und 10 ps an, wird also direkt aus PR* gebildet.
Links unten ist das Energieniveauschema gezeigt, das die optische Anregung und den biexponentiellen Zerfall des angeregten Zustands von Proteorhodopsin verdeutlicht. Beim Übergang in den Grundzustand durch die sogenannte konische Durchschneidung (CI, conical intersection)trennt sich die Population auf, die entweder in den cis-Zustand (K) reagiert ober in den trans-Zustand zurückkehrt. Da nur der cis-Zustand(60 Prozent der angeregten Moleküle) den Photozyklus durchläuft, liegt die Effizienz bei 0,6 gepumpten Protonen pro einfallendem Photon.Die Messung der zeitaufgelösten Absorption mit der Blitzlicht-Photolyse ist rechts oben zu sehen: Man erkennt neben dem bereits auf der Kurzzeitskala sichtbaren GSBSignal Absorptionsänderungen, die typisch für die Zwischenprodukte K, M1, M2, N und O sind. Aus diesen Daten lassen sich die Bildungs- und Zerfallszeiten der Zwischen-produkte entnehmen. Diese Zwischenprodukte entsprechen den Stufen des Protonentransports durch das Protein.
Der komplette Photozyklus von Proteorhodopsin ist unten rechts dargestellt. Die Doppelpfeile symbolisieren Reaktionen, bei denen auch die Rückreaktion berücksichtigt werden muss.[/vc_column_text][/vc_accordion_tab][/vc_accordion][vc_column_text css=“.vc_custom_1454492036955{margin-top: 20px !important;}“]
Schnelligkeit vermeidet Verluste
Um zu verstehen, warum die Ladungstrennung bei der Photosynthese mit hoher Effizienz und nahezu verlustfrei abläuft, nimmt man die Marcus-Theorie zu Hilfe. Sie erklärt die ultraschnellen Elektrontransferprozesse damit, dass eine vollständige Ladungstrennung nur ablaufen kann, wenn jegliche Rückraten vermieden werden. Im Reaktionszentrum wird dies durch einen sehr schnellen Ladungstransfer erreicht: Er geschieht über zwei Zwischenstufen (zum Bacteriochlorophyll in 3 ps und weiter zum Bacteriopheophytinin 0,65 ps). Gleichzeitig wird dabei die elektronische Energie abgesenkt. Dadurch wird das Elektron sofort räumlich vom »special pair« P getrennt, so dass es nicht »zurückkehren« (rekombinieren) kann. Weitere Elektrontransfer-Schritte können dann vergleichsweise langsam ablaufen; zum ersten Chinon QA innerhalb von 200 ps und zum terminalen Akzeptor QB innerhalb von Mikrosekunden (1 μs = 10-6 Sekunden).
Die Natur hat im Laufe der Evolution diesen grundlegenden Mechanismus viele Male abgewandelt und optimiert. So existieren leicht veränderte Versionen dieses Photosystems für viele Organismen. Sie sind durch Variation der Struktur an die Umgebungsparameter des jeweiligen Organismus angepasst. Einerseits finden wir das Photosystem in Schwefelbakterien, die in Meerestiefen zwischen 80 und 120 Metern leben und durchschnittlich nur 0,001 Prozent der Sonneneinstrahlung erhalten. Andererseits haben viele Organismen auch Schutzmechanismen entwickelt, um bei zu hoher Sonneneinstrahlung nicht durch Oxidation geschädigt zu werden [siehe Claudia Büchel, »Photosynthese zwischen Überfluss und Mangel«]. Auch hier ist die Kurzzeitspektroskopie die Schlüsseltechnologie zur Aufklärung der molekularen Abläufe: Im »Xanthophyll-Zyklus« wird ein Carotinoid im Antennensystem so modifiziert, dass es vom Lichtsammelpigment in eine »Energiesenke« verwandelt wird. Das neue Carotinoid kann Energie vom photoangeregten Zustand des Chlorophylls aufnehmen. Bei diesem Energietransfer wird die überschüssige Energie wegen der extrem kurzen Lebensdauer des angeregten Zustands im Carotinoid effizient in Wärme umgewandelt. Das schädliche Chlorophyll-Triplet (3Chl*) kann daher trotz hoher Lichtintensität nicht gebildet werden. So wird verhindert, dass hochreaktive Sauerstoffspezies entstehen, die zur Schädigung wichtiger Zellbestandteile wie Fettsäuren, Membrane, Proteine oder DNA führen.
Alternativen zur siliziumbasierten Solarzelle
Die kommerzielle Nutzung der Ladungstrennung nach Lichtabsorption wird derzeit durch die klassischen kristallinen Halbleitersolarzellen oder Dünnschichtsolarzellen dominiert. Parallel dazu werden vielversprechende neue Konzepte zur künstlichen Photosynthese erforscht, die auf der Kombination von nanokristallinen Materialien mit Farbstoffmolekülen basieren. Hier ist das vielleicht bekannteste Beispiel die Grätzelzelle. Diese photochemische Photovoltaikzelle besteht aus einem gesinterten, porösen Film aus Titandioxid (TiO2), an dem Farbstoffmoleküle (oft Rutheniumfarbstoffe) angelagert sind, und einem Elektrolyt. Nach Lichtabsorption wird ein Elektron vom angeregten Chromophor zur TiO2-Schicht transferiert, sodass sich ein elektrisches Potenzial zwischen den beiden Elektroden aufbaut. Der Elektrolyt gleicht die Ladung des ionisierten Chromophors wieder aus, womit der Stromkreis geschlossen ist. Die Grätzelzelle orientiert sich an der Photosynthese. Aber obwohl der primäre Elektrontransfer sogar noch schneller ist als in der Natur, gilt es, den Wirkungsgrad und die Langzeitstabilität noch zu verbessern.
Basierend auf diesem Konzept können nun die Materialien variiert werden. Insbesondere ist es möglich, die Chromophore durch Halbleiternanopartikel zu ersetzen, welche sehr stabil gegen Photodegradation sind. In unserer Gruppe werden aktuell Quantenpunkte auf ihre Eignung für diesen Einsatz getestet. Ein weiteres spannendes Projekt ist die Verwendung von Photoschaltern an der Oberfläche von TiO2-Kolloiden für den lichtkontrollierbaren Ladungstransfer.
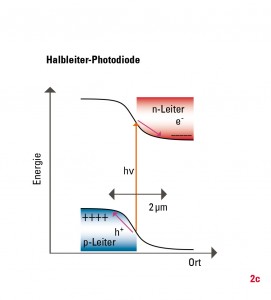
Warum ist die Effizienz der künstlichen Systeme deutlich geringer? Bei Silizium-Photozellen ist die ungewollte Rekombination der Ladungsträger, zum Beispiel an Störstellen des Halbleitermaterials, eine der Hauptursachen für Verluste. Das kann man zwar durch die hohe Reinheit des Halbleitermaterials vermeiden, aber dadurch erhöhen sich die Herstellungskosten. Die Ladungsträger (Elektronen und Löcher) müssen außerdem über eine Distanz von einigen Mikrometern getrennt werden, während es in natürlichen Systemen nur wenige Nanometer sind (Abb. 2). Zudem verläuft die Energieabsenkung der Ladungsträger in künstlichen Systemen kontinuierlich. Im Vergleich dazu geschieht die Ladungsträgertrennung der chlorophyllbasierten Photosynthese über vier diskrete Zwischenstufen ultraschnell und mit optimierter Energieabsenkung. Dies verhindert den Verlust durch Rekombination fast vollständig.
Rhodopsine: Licht verändert die Struktur
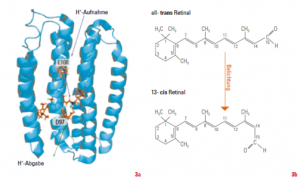
Neben der chlorophyllbasierten Photosynthese, die auf Elektrontransfer als primärer Photoreaktion beruht, hat die Natur noch ein weiteres, völlig unabhängiges Konzept entwickelt: Bei mikrobiellen Rhodopsinen (die gewisse strukturelle Ähnlichkeiten mit unserem Sehpigment Rhodopsin aufweisen) führt Belichtung zu einer Isomerisierung des Chromophors Retinal. Das heißt, es liegt dann in einer unterschiedlichen räumlichen Anordnung vor. Anschließend werden Protonen über die Membran transferiert.Bacteriorhodopsin wurde als das erste biologische System dieser Art vor über 40 Jahren im Archaebakterium Halobacterium salinarum entdeckt.
Der transmembrane Protontransfer erfolgt vom Zellinneren nach außen und führt zu einem elektrochemischen Gradienten über die Membran. Interessant ist, dass die Konformationsänderungen des Chromophors in einem Zyklus ablaufen: Nach Absorption von Licht wird Retinal durch Photoisomerisierung von seiner gestreckten all-trans- in seine gewinkelte 13-cis-Konfiguration überführt. Dadurch wird eine Reihe von Reaktionsschritten im Protein ausgelöst, deren Dauer von 500 fs bis in den Bereich von Millisekunden reicht. Auch diese Prozesse wurden durch zeitaufgelöste optische Spektroskopie im Detail aufgeklärt.
In der letzten Dekade hat sich das Spektrum der bekannten Rhodopsine rasant erweitert. Mittlerweile kennt man Vertreter dieser Proteinfamilie mit unterschiedlichen Funktionen in allen drei Domänen des Lebens. Proteobakterien sind beispielsweise Organismen, die ihre Energie aus Licht beziehen und eine wichtige Rolle in marinen Ökosystemen spielen. Ihre Photorezeptoren, die Proteorhodopsine, fungieren ähnlich wie Bacteriorhodopsin als lichtgetriebene Protonenpumpen (Abb. 3). Durch die Kombination verschiedener biophysikalischer Methoden im Rahmen des Sonderforschungsbereichs 807 konnte in Frankfurt die Funktionsweise von Proteorhodopsin im Detail aufgeklärt werden (siehe Erklärung zu »Zeitaufgelöste Veränderung der Absorption von Proteorhodopsin« weiter oben).
Die mikrobiellen Rhodopsine sind auch aus einem weiteren Grund ein faszinierendes Studienobjekt: Ausgehend von einer sehr gut konservierten Grundstruktur (7-TM-Helix-Motiv) kann die Funktion des Proteins durch minimale Variationen dramatisch geändert werden: Aus einer Pumpe wird ein Sensor oder ein Ionenkanal. Der prominenteste Vertreter der letzten Klasse ist sicherlich das Channelrhodopsin 2 (ChR2), ein lichtgetriebener Kationenkanal. Seine Fähigkeit, bei Belichtung die Membran jeder ChR2 exprimierenden Zelle zu depolarisieren, hat dieses Algenrhodopsin zum Hauptwerkzeug der Optogenetik gemacht [Ernst Bamberg: »Licht steuert Nervenzellen mit höchster Präzision«]. Dort wird es beispielsweise eingesetzt, um Aktionspotenziale in neuronalen Zellen durch die Einstrahlung von Licht auszulösen [siehe Alexander Gottschalk: »Ein kleiner Wurm ist Liebling der Optogenetiker«]. Interessanterweise ist der genaue Mechanismus der Kopplung zwischen dem Lichtrezeptorteil und dem Ionenkanalteil in ChR2 noch nicht vollständig verstanden und wird daher im Zentrum unserer zukünftigen Forschungsinteressen stehen.
[dt_call_to_action content_size=“small“ background=“fancy“ line=“true“ animation=“fadeIn“]
Die Autoren

Privatdozent Dr. Markus Braun, 45, studierte Physik an der Universität Bayreuth und promovierte an der Universität Stuttgart. Nach einem Postdoktorat am Georgia Institute of Technology habilitierte er sich an der Ludwig-Maximilians-Universität München. Seit 2009 ist er als Akademischer Oberrat am Institut für Physikalische und Theoretische Chemie tätig. Er interessiert sich für Entwicklung von Kurzzeitlaserquellen und für Anwendungen in der Spektroskopie von Molekülen und Festkörpern. braun@theochem.uni-frankfurt.de
Prof. Dr. Josef Wachtveitl, Jahrgang 1960, studierte Physik an der Universität Regensburg und promovierte am Max-Planck-Institut für Biochemie in Martinsried. Er habilitierte sich an der Ludwig-Maximilians-Universität München. Seit 2000 ist er Professor für Physikalische Chemie an der Goethe-Universität. Seine Arbeitsschwerpunkte sind die zeitaufgelöste biomolekulare Spektroskopie, die Struktur und Funktion von Photorezeptoren, die Konformationsdynamik von Biopolymeren sowie natürliche und künstliche photosynthetische beziehungsweise photoschaltbare Systeme. wveitl@theochem.uni-frankfurt.de
[/dt_call_to_action]
Der Artikel ist erschienen in Forschung Frankfurt 2/2015: Photosynthese verstehen, Photovoltaik verbessern.[/vc_column_text][/vc_column][/vc_row]